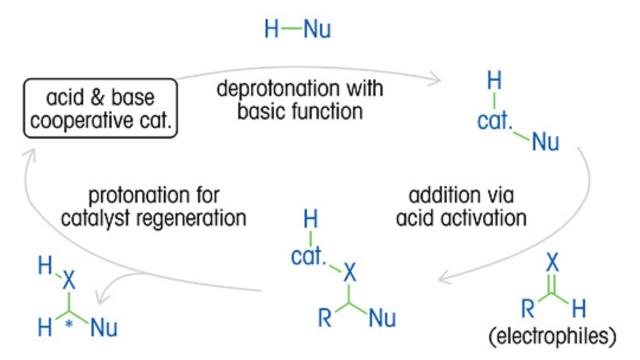
Une compréhension approfondie de la cinétique de réaction, du mécanisme, des cycles catalytiques et de l’impact des variables est essentielle pour optimiser les rapports énantiomériques et le rendement du produit, ainsi que pour réduire les coûts et les déchets.
Pour obtenir des données précises, il est essentiel de contrôler avec précision les paramètres fondamentaux de la réaction tels que la température, la pression, le débit de dosage du réactif et le taux d’agitation. Les réacteurs de laboratoire automatisés sont largement utilisés dans les milieux universitaires et industriels pour réaliser ce contrôle. L’extension récente des capacités du réacteur de laboratoire EasyMax™ pour inclure un contrôle précis de la température jusqu’à -78 °C élargit l’espace de conception des processus catalytiques .
Un contrôle supérieur du réacteur améliore la précision des mesures de réaction, y compris l’analyse des réactifs, des réactifs, des espèces de catalyseurs, des intermédiaires transitoires et des impuretés des sous-produits. Le suivi en temps réel des espèces réactionnelles permet de collecter des expériences riches en données qui peuvent éclairer le développement de paramètres cinétiques et soutenir les mécanismes de réaction proposés, y compris les cycles catalytiques.
La spectroscopie FTIR et Raman in situ, en temps réel sont des techniques établies pour mieux comprendre les réactions catalytiques. Les spectromètres ReactIR™ et ReactRaman™ ont été conçus pour l’analyse des réactions chimiques, offrant une gamme de sondes d’insertion et de cellules d’écoulement capables de gérer la large gamme de températures et de pressions souvent requises pour les études de réactions catalytiques.
L’échantillonnage automatisé des réactions chimiques permet d’augmenter la productivité en relevant les défis à deux échelles :
- Outils d’échantillonnage manuels, tels que pipettes et seringues
- Le processus d’échantillonnage manuel lui-même, avec des réactions difficiles sensibles à la température, à la pression ou à l’air
EasySampler™ est un système d’échantillonnage de réacteur automatisé conçu pour l’acquisition en ligne, la trempe et la dilution d’échantillons de réaction. Il permet de récupérer des échantillons dans des conditions de réaction et élimine les défis du processus d’échantillonnage manuel.
DirectInject-LC™ fournit une analyse in situ et en temps réel des réactions chimiques à l’aide de mesures chromatographiques. Le système automatisé résout les problèmes difficiles inhérents à la chromatographie, tels que l’échantillonnage de réaction, la trempe, la dilution et l’interfaçage avec le chromatographe. DirectInject-LC différencie et mesure les espèces clés au fur et à mesure que la réaction se déroule, ce qui permet une compréhension approfondie de la cinétique de la réaction, du mécanisme et de l’effet des variables sur le résultat de la réaction. DirectInject-LC s’interface avec les systèmes HPLC-MS, UHPLC et HPLC chiral pour une capacité de séparation et d’analyse avancée.
Lors de l’extension des réactions catalytiques, les progrès récents de la modélisation des réactions chimiques fournissent les informations nécessaires pour des réactions plus sûres, à haut rendement et avec moins d’impuretés. La modélisation dynamique des données expérimentales offre également des informations plus approfondies sur la cinétique des réactions et l’effet des variables de réaction.