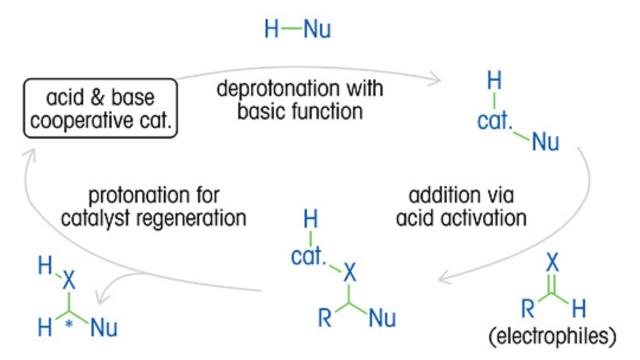
Ein gründliches Verständnis der Reaktionskinetik, des Mechanismus, der katalytischen Zyklen und der Auswirkungen von Variablen ist unerlässlich, um die Enantiomerenverhältnisse und die Produktausbeute zu optimieren sowie Kosten und Abfall zu reduzieren.
Um genaue Daten zu erhalten, ist eine präzise Steuerung grundlegender Reaktionsparameter wie Temperatur, Druck, Reaktantendosierleistung und Rührgeschwindigkeit von entscheidender Bedeutung. Automatisierte Laborreaktoren werden häufig in akademischen und industriellen Umgebungen eingesetzt, um diese Kontrolle zu erreichen. Die jüngste Erweiterung der Fähigkeiten von EasyMax-Laborreaktoren™ um eine präzise Temperaturregelung von bis zu -78 °C erweitert den Designraum für katalytische Prozesse.
Eine überlegene Reaktorsteuerung verbessert die Genauigkeit von Reaktionsmessungen, einschließlich der Analyse von Reagenzien, Reaktanten, Katalysatorspezies, transienten Zwischenprodukten und Nebenproduktverunreinigungen. Die Echtzeit-Verfolgung von Reaktionsspezies ermöglicht die Sammlung von datenreichen Experimenten, die die Entwicklung kinetischer Parameter unterstützen und vorgeschlagene Reaktionsmechanismen, einschließlich katalytischer Zyklen, unterstützen können.
In-situ-, Echtzeit-FTIR- und Raman-Spektroskopie sind etablierte Techniken, um ein tieferes Verständnis katalytischer Reaktionen zu erlangen. ReactIR™- und ReactRaman-Spektrometer™ wurden für die chemische Reaktionsanalyse entwickelt und bieten eine Reihe von Einstechsonden und Durchflusszellen, die den breiten Temperatur- und Druckbereich bewältigen können, der häufig für katalytische Reaktionsuntersuchungen erforderlich ist.
Die automatisierte Probenahme chemischer Reaktionen ermöglicht eine höhere Produktivität, indem Herausforderungen auf zwei Ebenen angegangen werden:
- Manuelle Probenahmewerkzeuge wie Pipetten und Spritzen
- Der manuelle Probenahmeprozess selbst mit schwierigen temperatur-, druck- oder luftempfindlichen Reaktionen
EasySampler™ ist ein automatisiertes Reaktorprobenahmesystem, das für die Inline-Erfassung, das Quenchen und die Verdünnung von Reaktionsproben entwickelt wurde. Es ermöglicht die Entnahme von Proben unter Reaktionsbedingungen und eliminiert Herausforderungen bei der manuellen Probenahme.
DirectInject-LC™ ermöglicht die In-situ-Echtzeitanalyse chemischer Reaktionen mithilfe chromatographischer Messungen. Das automatisierte System befasst sich mit den inhärenten schwierigen Problemen, die mit der Chromatographie verbunden sind, wie z. B. Reaktionsprobenahme, Quenching, Verdünnung und Schnittstelle zum Chromatographen. DirectInject-LC differenziert und misst Schlüsselspezies während der Reaktion, was zu einem tiefgreifenden Verständnis der Reaktionskinetik, des Mechanismus und der Wirkung von Variablen auf das Reaktionsergebnis führt. DirectInject-LC ist Schnittstellen zu HPLC-MS-, UHPLC- und chiralen HPLC-Systemen für erweiterte Trenn- und Analysefunktionen.
Bei der Skalierung katalytischer Reaktionen liefern die jüngsten Fortschritte in der Modellierung chemischer Reaktionen die Informationen, die für sicherere Reaktionen mit höherer Ausbeute und weniger Verunreinigungen erforderlich sind. Die dynamische Modellierung experimenteller Daten bietet auch tiefere Einblicke in die Reaktionskinetik und die Wirkung von Reaktionsvariablen.