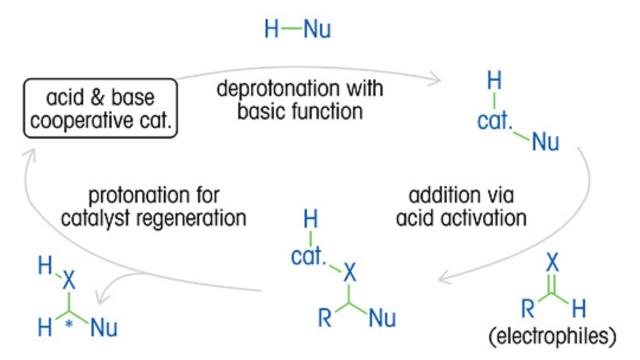
Una comprensión profunda de la cinética de reacción, el mecanismo, los ciclos catalíticos y el impacto de las variables es esencial para optimizar las proporciones enantioméricas y el rendimiento del producto, así como para reducir los costos y el desperdicio.
Para obtener datos precisos, es fundamental un control preciso de los parámetros fundamentales de la reacción, como la temperatura, la presión, la tasa de dosificación del reactivo y la velocidad de agitación. Los reactores de laboratorio automatizados se utilizan ampliamente en entornos académicos e industriales para lograr este control. La reciente expansión de las capacidades del reactor de laboratorio EasyMax™ para incluir un control preciso de la temperatura tan baja como -78 °C amplía el espacio de diseño para los procesos catalíticos.
El control superior del reactor mejora la precisión de las mediciones de reacción, incluido el análisis de reactivos, reactivos, especies de catalizadores, intermedios transitorios e impurezas de subproductos. El seguimiento en tiempo real de las especies de reacción permite la recopilación de experimentos ricos en datos que pueden informar el desarrollo de parámetros cinéticos y respaldar los mecanismos de reacción propuestos, incluidos los ciclos catalíticos.
La espectroscopia FTIR y Raman in situ y en tiempo real son técnicas establecidas para obtener una comprensión más profunda de las reacciones catalíticas. Los espectrómetros ReactIR™ y ReactRaman™ fueron diseñados para el análisis de reacciones químicas, ofreciendo una gama de sondas de inserción y celdas de flujo que pueden manejar la amplia gama de temperaturas y presiones que a menudo se requieren para las investigaciones de reacciones catalíticas.
El muestreo automatizado de reacciones químicas permite aumentar la productividad al abordar los desafíos en dos escalas:
- Herramientas de muestreo manuales, como pipetas y jeringas
- El propio proceso de muestreo manual, con reacciones desafiantes de temperatura, presión o sensibilidad al aire
EasySampler™ es un sistema automatizado de muestreo de reactores diseñado para la adquisición, enfriamiento y dilución en línea de muestras de reacción. Permite recuperar muestras en condiciones de reacción y elimina los desafíos del proceso de muestreo manual.
DirectInject-LC™ ofrece análisis in situ y en tiempo real de reacciones químicas mediante mediciones cromatográficas. El sistema automatizado aborda los problemas difíciles inherentes asociados con la cromatografía, como el muestreo de reacciones, el enfriamiento, la dilución y la interfaz con el cromatógrafo. DirectInject-LC diferencia y mide las especies clave a medida que avanza la reacción, lo que proporciona una comprensión profunda de la cinética de la reacción, el mecanismo y el efecto de las variables en el resultado de la reacción. DirectInject-LC interactúa con sistemas HPLC-MS, UHPLC y HPLC quiral para una capacidad avanzada de separación y análisis.
Al aumentar el escalado de las reacciones catalíticas, los avances recientes en el modelado de reacciones químicas proporcionan la información necesaria para reacciones más seguras y de mayor rendimiento con menos impurezas. El modelado dinámico de datos experimentales también ofrece información más profunda sobre la cinética de la reacción y el efecto de las variables de reacción.