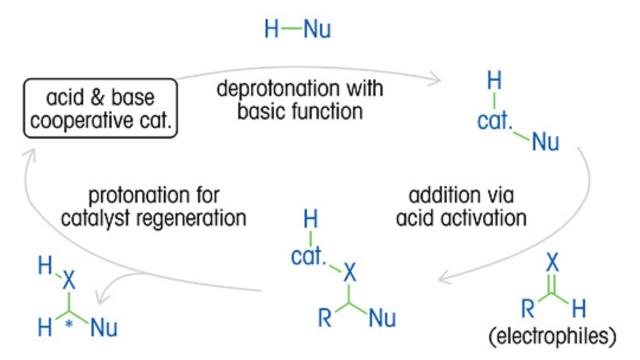
Uma compreensão completa da cinética da reação, mecanismo, ciclos catalíticos e o impacto das variáveis é essencial para otimizar as proporções enantioméricas e o rendimento do produto, bem como reduzir custos e desperdícios.
Para obter dados precisos, é fundamental o controle preciso dos parâmetros fundamentais da reação, como temperatura, pressão, taxa de dosagem do reagente e taxa de agitação. Os reatores de laboratório automatizados são amplamente utilizados em ambientes acadêmicos e industriais para alcançar esse controle. A recente expansão dos recursos do reator de laboratório EasyMax™ para incluir controle preciso de temperatura tão baixo quanto -78 °C expande o espaço de projeto para processos catalíticos.
O controle superior do reator aumenta a precisão das medições de reação, incluindo a análise de reagentes, reagentes, espécies de catalisadores, intermediários transitórios e impurezas de subprodutos. O rastreamento em tempo real de espécies de reação permite a coleta de experimentos ricos em dados que podem informar o desenvolvimento de parâmetros cinéticos e apoiar os mecanismos de reação propostos, incluindo ciclos catalíticos.
A espectroscopia FTIR e Raman in situ e em tempo real são técnicas estabelecidas para obter uma compreensão mais profunda das reações catalíticas. Os espectrômetros ReactIR™ e ReactRaman™ foram projetados para análise de reações químicas, oferecendo uma variedade de sondas de inserção e células de fluxo que podem lidar com a ampla faixa de temperaturas e pressões frequentemente necessárias para investigações de reações catalíticas.
A amostragem automatizada de reações químicas permite aumentar a produtividade, abordando desafios em duas escalas:
- Ferramentas de amostragem manual, como pipetas e seringas
- O próprio processo de amostragem manual, com temperatura, pressão ou reações sensíveis ao ar desafiadoras
O EasySampler™ é um sistema automatizado de amostragem de reator projetado para aquisição, têmpera e diluição em linha de amostras de reação. Ele permite que as amostras sejam recuperadas em condições de reação e elimina os desafios do processo de amostragem manual.
O DirectInject-LC™ oferece análise in-situ e em tempo real de reações químicas usando medições cromatográficas. O sistema automatizado aborda os problemas difíceis inerentes associados à cromatografia, como amostragem de reação, têmpera, diluição e interface com o cromatógrafo. O DirectInject-LC diferencia e mede espécies-chave à medida que a reação prossegue, produzindo uma compreensão profunda da cinética da reação, do mecanismo e do efeito das variáveis no resultado da reação. O DirectInject-LC faz interface com sistemas HPLC-MS, UHPLC e HPLC quiral para capacidade avançada de separação e análise.
Ao aumentar a escala de reações catalíticas, os avanços recentes na modelagem de reações químicas fornecem as informações necessárias para reações mais seguras e de maior rendimento com menos impurezas. A modelagem dinâmica de dados experimentais também oferece insights mais profundos sobre a cinética da reação e o efeito das variáveis da reação.