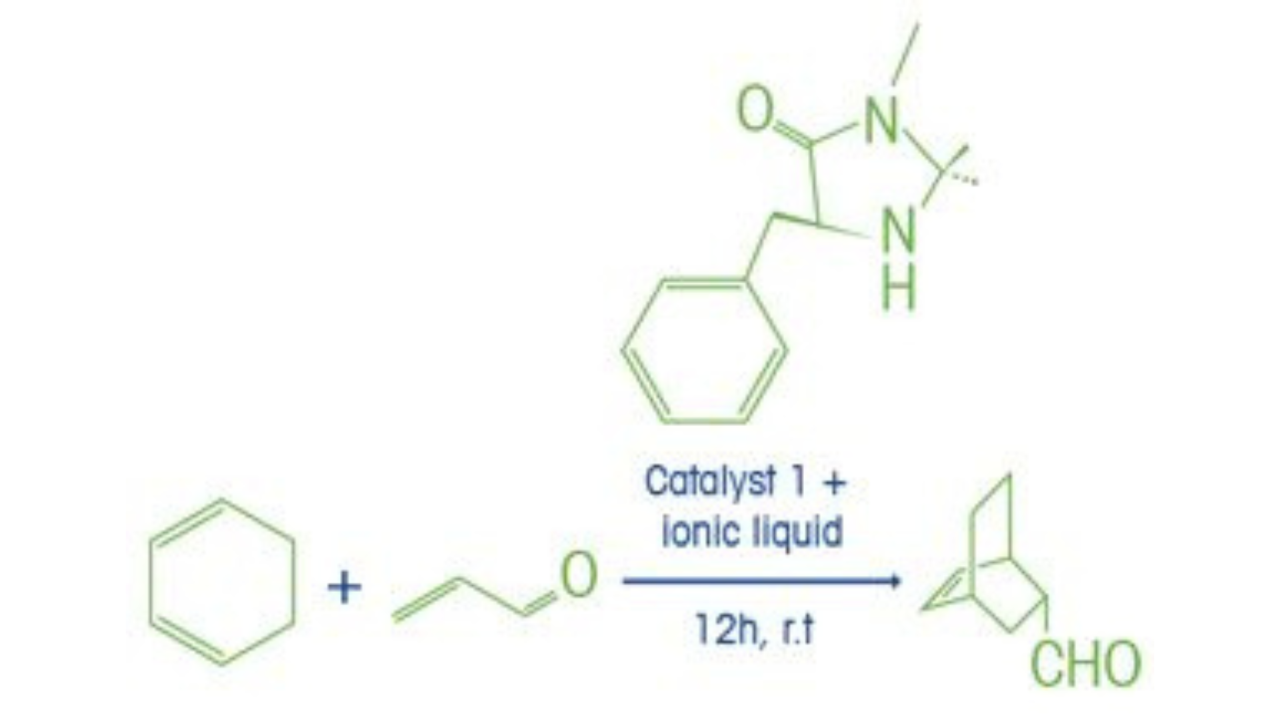
Katalyserade reaktioner används vanligtvis för att påskynda hastigheten med vilken en specifik kemi fortskrider. I huvudsak är katalysatorns verkan att tillhandahålla en alternativ väg med lägre energi för reaktionen. För att detta ska ske interagerar det katalytiska ämnet med en reaktant och bildar en intermediär förening. Denna intermediär är övergående på så sätt att efter att den har bildats, bryts den sönder och lämnar den ursprungliga katalysatorarten oförändrad. En katalysator påverkas inte av reaktionen så långt som den kemiska strukturen eller massan vid reaktionens slut.
Det finns två allmänna typer av katalyserade reaktioner:
- Heterogen katalyserad reaktion är när katalysatorn och reaktanten existerar i två olika faser, såsom en fast katalysator med en reaktant i lösning.
- Homogen katalyserad reaktion är när katalysatorn och reaktanten är i samma fas, såsom när katalysatorn och reaktanterna löses upp i samma lösning.