Wu, J., Wang, L., Xu, S., Cao, Y., Han, Z. et Li, H. (2023). Hydrogénation séquentielle des nitroaromatiques en amines alicycliques via des nanoparticules Ru-hautement dispersées ancrées sur des nanofeuillets de C3N4 exfoliés à l’air. RSC Advances, 13(3), 2024-2035. https://doi.org/10.1039/d2ra07612h
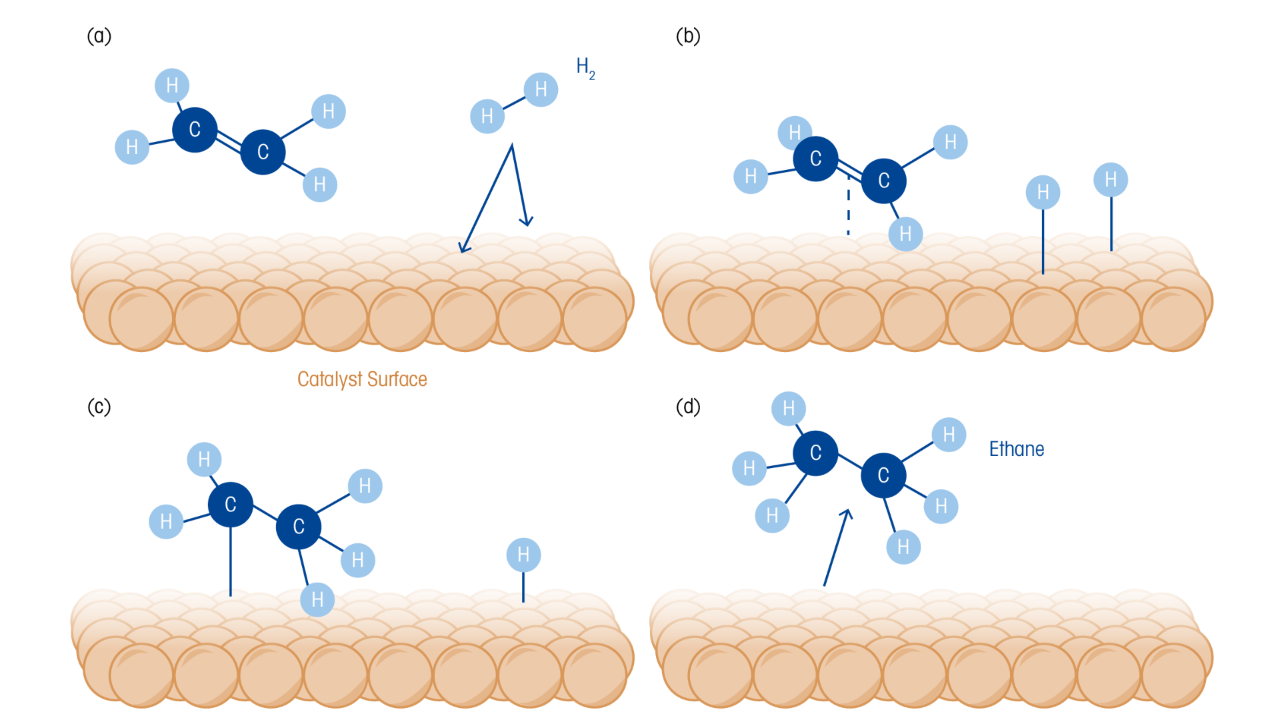
L’hydrogénation des nitroaromatiques par des méthodes catalytiques vertes est hautement souhaitable pour produire des amines alicycliques vitales ; Cependant, à l’échelle, cela est compliqué par les différents comportements d’adsorption du groupe nitro et du cycle benzène. Les catalyseurs à base de Ru sont très efficaces pour l’hydrogénation en une étape des nitroaromatiques en amines alicycliques. Pourtant, la question de l’absorption compétitive complique la synthèse et nécessite des conditions de réaction difficiles. Il a été démontré que les catalyseurs à base de ont une excellente activité et une sélectivité pour l’hydrogénation des groupes nitro, même dans des conditions douces. Les auteurs commentent que le C₃N₄ dopé au Ru avait précédemment démontré une hydrogénation en cycle aromatique efficace. Par conséquent, pour la conversion du nitrobenzène (NB) en cyclohexylamine (CHA), ils ont préparé un support C₃N₄ exfolié à l’air contenant des sites actifs doubles Ru-hautement dispersés pour l’hydrogénation catalytique du groupe nitroaromatique nitro et du cycle benzénique, respectivement.
Une série d’études physiques et spectroscopiques ont été entreprises pour caractériser et définir pleinement la relation structure-performance de ce nouveau système catalytique. Ces études comprenaient la détermination de la morphologie du support C₃N₄, la distribution et l’interaction des particules Ru et à la surface du catalyseur, ainsi que la dissociation et l’activation de H₂ dans des conditions douces. Dans les tests de performance du catalyseur, une réaction NB à CHA a été réalisée pour étudier plus en détail l’effet des variables de réaction. Un catalyseur avec 1,5 % Ru–1,5 %/C₃N₄ a réagi à 80 °C et 3 MPa H₂ pendant 3 h a donné une conversion NB de 100,0 % et une sélectivité CHA de 96,8 %.
Operando FTIR (ReactIR) a été utilisé via un autoclave construit sur mesure équipé d’une sonde ATR en diamant pour des mesures in situ et en temps réel afin d’étudier la voie d’hydrogénation du NB à l’OCH. Les mesures ReactIR ont montré un spectre avec de forts pics à 1350 cm⁻¹ et 1531 cm⁻¹ résultant de l’étirement symétrique et asymétrique C–NO₂ au Nouveau-Brunswick. Au fur et à mesure que la réaction se poursuivait, l’intensité maximale diminuait rapidement, indiquant une conversion rapide de NB. Parallèlement, les bandes de 1606 cm¹ et de 1630 cm¹ ont augmenté de manière significative, ce qui a été associé à la transformation du groupe nitro en amine, indiquant que l’aniline était formée par l’hydrogénation directe de NB. La poursuite de l’hydrogénation a entraîné une diminution progressive des pics d’amines, reflétant l’hydrogénation du cycle benzénique pour former du naphtène. Les doubles pics à 1606 cm⁻¹ et 1630 cm⁻¹ contribuent également à une vibration du squelette du cycle benzénique, affaiblie par l’hydrogénation du cycle, lors de la conversion de l’AN en CHA. En suivant les changements dans les bandes spectrales clés en fonction du temps, les mesures ReactIR ont démontré la nature en deux étapes du processus d’hydrogénation, l’hydrogénation du groupe nitro se produisant avant l’étape déterminante de la taux, l’hydrogénation du cycle benzénique.
Une voie réactionnelle a été proposée sur la base de la combinaison des résultats de l’IR operando et des expériences GC-MS. Initialement, le groupe nitro est converti en un amino, générant de l’aniline. Avec l’hydrogénation supplémentaire du cycle benzénique, l’aniline se transforme en cyclohexylamine. Des sous-produits du cyclohexanol et de la dicyclohexylamine ont également été observés, résultant de la désamination de l’AN et de la condensation de la CHA au fur et à mesure de l’hydrogénation. Des études cinétiques ont montré que le dominait l’hydrogénation du groupe nitro, tandis que le Ru était dominant pour le cycle benzénique. Les auteurs ont noté que l’activité du catalyseur était considérablement améliorée par l’action des métaux non dominants, ce qui augmentait l’activation et la dissociation de H₂. Les sites Ru-Nₓ et-Nₓ hautement dispersés lors de la séparation à l’échelle nanométrique et l’hydrogénation assistée par métal susmentionnée ont également contribué à la performance du catalyseur.