Zhang, Z., Bae, H. Y., Guin, J., Rabalakos, C., Van Gemmeren, M., Leutzsch, M., Klussmann, M., & List, B. (2016). Organocatalyse asymétrique à l’acide de Lewis dirigée contre le contre-anion pour la cyanosilylation évolutive des aldéhydes. Nature Communications, 7(1). https://doi.org/10.1038/ncomms12478
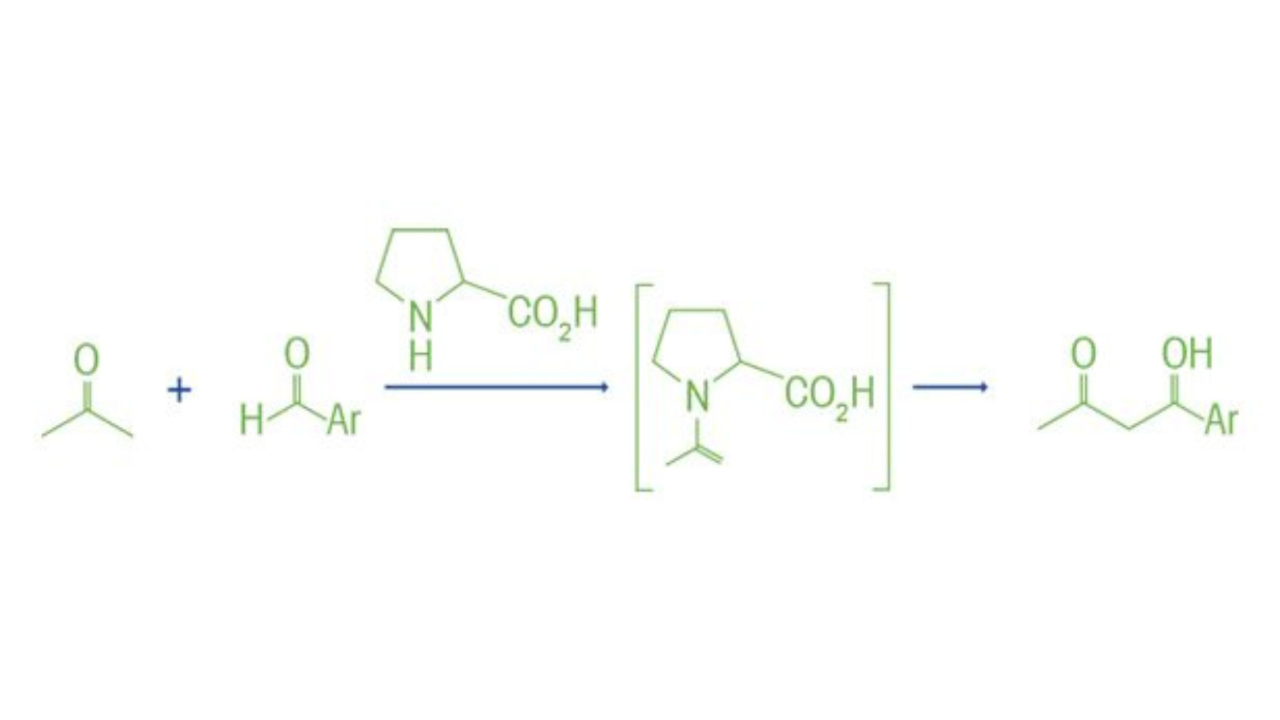
Les auteurs rapportent avoir mis au point une méthode d’organocatalyse asymétrique à l’acide de Lewis pour la cyanosilylation des aldéhydes à l’aide de cyanure de triméthylsilyle et d’un précatalyseur de disulfonimide chiral. En raison de l’activité élevée, des charges catalytiques de 0,05 % à 0,005 % ont été efficaces pour produire le produit de cyanohydrine souhaité. Les auteurs rapportent qu’une période d’inactivité du catalyseur est observée qui peut être induite de manière réversible par l’eau. La FTIR in situ a été utilisée pour mieux comprendre ce développement et a fourni des informations importantes sur le cycle pré-catalytique.
Pour surveiller la concentration du réactif aldéhyde, la bande carbonyle de 1703 cm-1 a été suivie en fonction du temps. Il est intéressant de noter qu’aucune réaction n’a été observée pendant un certain temps, après quoi la transformation s’est déroulée assez rapidement. Les auteurs pensaient que la raison de la période de dormance pouvait être liée à l’eau dans le mélange réactionnel, et un protocole expérimental d’ajout de quantités contrôlées d’eau au mélange réactionnel a prouvé que l’eau était effectivement responsable du manque d’activité via l’hydrolyse de l’espèce catalytiquement active. Dans des travaux antérieurs dans lesquels un acétal de silylcétène a réagi avec un aldéhyde en présence d’un catalyseur disulfonimide, aucune période de dormance n’a été observée. Ils pensaient que cela pourrait être dû à la forte réactivité de l’acétal de silylcétène avec le pré-catalyseur, régénérant instantanément l’organocatalyseur actif à l’acide de Lewis. Pour tester cette hypothèse dans les travaux actuels, ils ont utilisé une quantité catalytique d’acétal de silylcétène comme activateur et ont constaté que la période de dormance était évitée. Sur la base d’autres expériences, ils ont proposé un cycle pré-catalytique qui reflète la période de dormance.