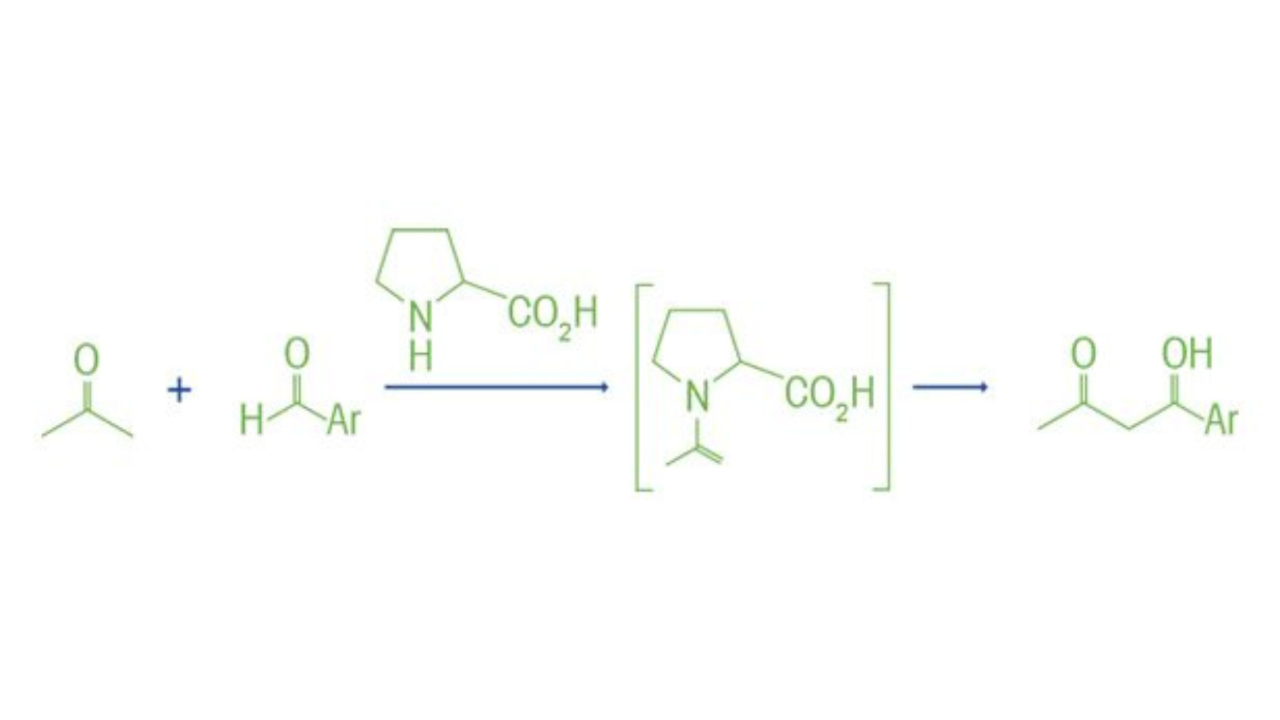
Zhang, Z., Bae, H. Y., Guin, J., Rabalakos, C., Van Gemmeren, M., Leutzsch, M., Klussmann, M., & List, B. (2016). Organocatálisis ácida de Lewis asimétrica dirigida por contraanión para la cianosililación escalable de aldehídos. Nature Communications, 7(1). https://doi.org/10.1038/ncomms12478
Los autores informan sobre el desarrollo de un método asimétrico de organocatálisis con ácido de Lewis para la cianosililación de aldehídos utilizando cianuro de trimetilsilil y un precatalizador de disulfonimida quiral. Como resultado de la alta actividad, las cargas de catalizador de 0,05 % a 0,005 % fueron efectivas para producir el producto de cianohidrina deseado. Los autores informan que se observa un período de inactividad del catalizador que puede ser inducido reversiblemente por el agua. Se utilizó FTIR in situ para comprender mejor este desarrollo y proporcionó información significativa sobre el ciclo precatalítico.
Para monitorear la concentración del reactivo aldehído, se realizó un seguimiento de la banda de carbonilo de 1703 cm-1 en función del tiempo. Curiosamente, no se observó ninguna reacción durante un período de tiempo, después del cual la transformación procedió con bastante rapidez. Los autores pensaron que la razón del período de inactividad podría estar relacionada con el agua en la mezcla de reacción, y un protocolo experimental de adición de cantidades controladas de agua a la mezcla de reacción demostró que el agua era responsable de la falta de actividad a través de la hidrólisis de las especies catalíticamente activas. En trabajos anteriores en los que un acetal de ceteno de sililo se hizo reaccionar con un aldehído en presencia de un catalizador de disulfinomimida, no se observó un período de latencia. Pensaron que esto podría deberse a la alta reactividad del acetal de silil ceteno con el precatalizador, regenerando instantáneamente el organocatalizador activo del ácido de Lewis. Para probar esta hipótesis en el trabajo actual, utilizaron una cantidad catalítica de acetal de silil ceteno como activador y encontraron que se evitaba el período de latencia. Sobre la base de otros experimentos, propusieron un ciclo precatalítico que refleja el período de inactividad.