Yetra, S. R., Schmitt, N. et Tambar, Royaume-Uni (2022). α-alkylation énantiosélective photochimique catalytique avec des sels de pyridinium. Science chimique, 14(3), 586-592. https://doi.org/10.1039/d2sc05654b
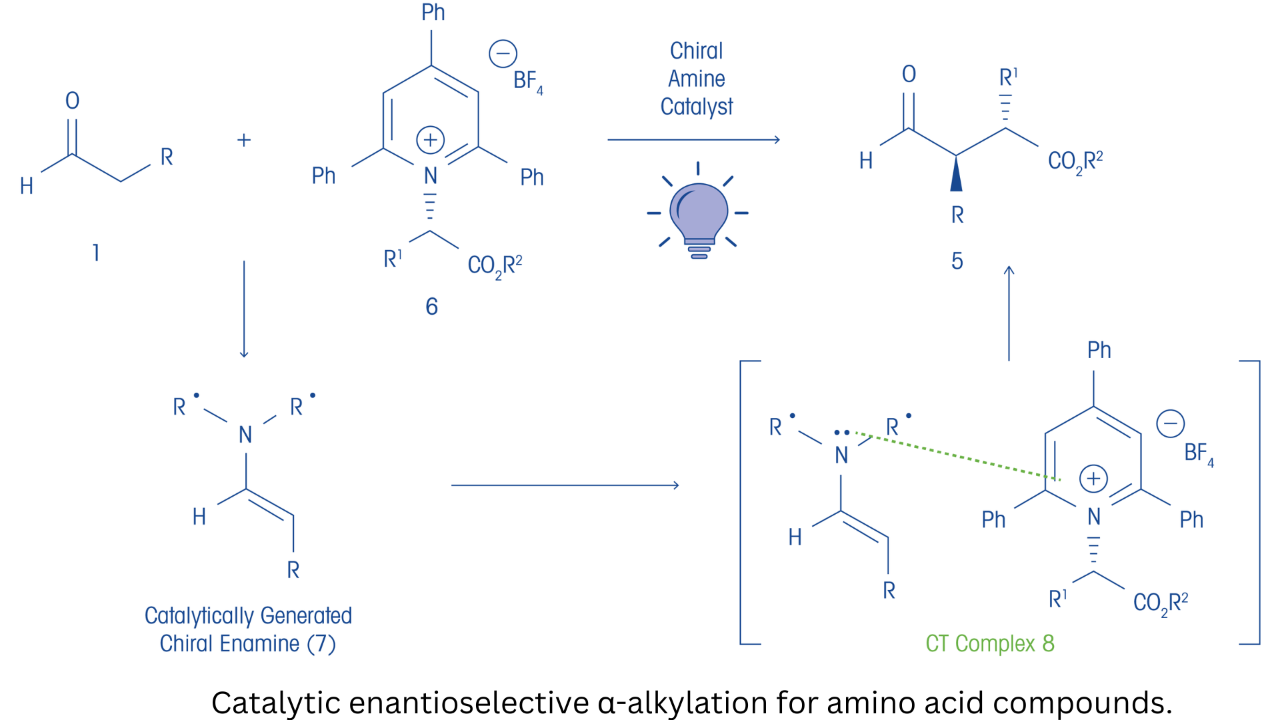
Les auteurs ont fait remarquer que les halogénures d’alkyle et les sulfonates sont des agents alkylants fréquemment utilisés dans la catalyse asymétrique pour la α-alkylation énantiosélective des énolates. Leur intérêt était de développer un processus photochimique pour les alkylations énantiosélectives qui utilise des sources renouvelables et durables de réactifs alkylants tels que des substrats dérivés d’acides aminés. Étant donné la faible capacité d’acceptation des électrons des dérivés d’acides aminés dans les alkylations d’énolates, le défi était de développer un moyen d’activer ces composés. Sur la base de travaux antérieurs dans la littérature, les auteurs ont postulé que l’utilisation de sels de pyridinium dérivés d’acides aminés comme agents alkylants serait efficace, étant donné que les sels de pyridinium sont connus pour être utilisés comme précurseurs radicaux dans les α-alkylations énantiosélectives. Ils ont proposé que les sels de pyridinium forment des complexes d’état fondamental avec des équivalents d’énolate chiral riches en électrons générés par catalyse. Dans une vaste série d’expériences, ils ont montré qu’un sel de Katritzky déficient en électrons dérivé de l’ester 2,2,2-trifluoroéthylique de glycine réagissait dans des conditions utilisant un catalyseur d’amine chirale, de la 2,6-lutidine et une irradiation à 427 nm, fournissant le produit de α-alkylation souhaité.
Des travaux supplémentaires ont montré que l’utilisation d’un milieu basique de Lewis, tel que l’acétamide de diméthyle, améliorait le rendement (jusqu’à 40 %) et fournissait un excellent excès énantiomérique (ee. 92 %). De plus, l’utilisation d’additifs tels que l’iodure de sodium qui améliorent la complexification de l’état fondamental des composants de la réaction a permis d’obtenir des rendements de 75 % avec 92 % d’ee. Grâce à des études mécanistes approfondies, ils ont postulé que la réaction catalytique énantiosélective peut se dérouler simultanément via un mécanisme de combinaison radicalaire en cage et un mécanisme de chaîne radicalaire. Les chercheurs ont ensuite compris la portée de la réaction photocatalytique, y compris l’utilisation du processus dans la synthèse totale des produits naturels de lignane (−)-entérolactone et (-)-entérodiol.
L’une des observations clés de leur travail était l’importance cruciale du contrôle de la température de réaction. La réalisation de ces réactions à température ambiante a affecté négativement l’énantiosélectivité, et le maintien de 92 % ee a nécessité l’exécution de la réaction à une température de 4 °C. Le contrôle de la température était difficile car la réaction était continuellement irradiée par une source lumineuse près de la cuve. Pour cette raison, les chercheurs ont utilisé un système EasyMax 102. Dans un article mettant en lumière les travaux du professeur Tambur sur la α-alkylation énantiosélective photochimique catalytique à l’aide de sels de pyridinium (Synform, 2023/06, A100-A105), il commente : « Nous avons finalement acheté le système de thermostat avancé EasyMax 102 de Mettler-Toledo AutoChem, Inc. Il s’est avéré être l’achat le plus important pour la réussite du projet. Bien que l’EasyMax n’ait jamais été utilisé pour les réactions photochimiques, nous avons identifié deux caractéristiques clés de cet instrument. Tout d’abord, il permet de maintenir une température de réaction basse et constante pendant de longues périodes. Deuxièmement, l’instrument dispose d’une fenêtre transparente sur la chambre de réaction, qui est généralement utilisée pour voir
dans la réaction, mais nous avons identifié cela comme une opportunité de faire briller la lumière d’une lampe à une distance contrôlée sans affecter la température de réaction. Pour notre plus grand plaisir, l’EasyMax a fourni un nouveau niveau de constance dans nos résultats.