
白皮书:绿色化学中的不对称催化
本白皮书介绍了最近同行评审研究的示例,这些示例展示了梅特勒 托利多技术提供的深入信息和精确控制如何帮助支持四个主题中的绿色和可持续化学:
- 绿色合成和工艺
- 通过连续加工实现可持续性
- 可再生资源的价值化
- 二氧化碳封存和使用
不对称催化或对映选择性催化是一种从非手性起始材料产生手性化合物的化学反应。在这种类型的催化中,催化剂本身是手性的,它选择性地诱导在其镜像上形成特定的立体异构体。
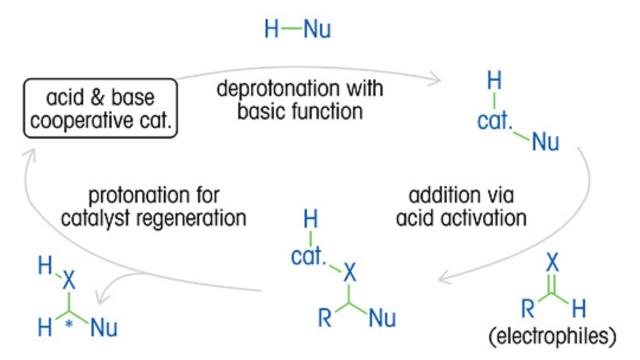
不对称催化,通常涉及过渡金属有机金属催化剂,如铑,提供了一种高效和选择性的方法。研究人员现在正专注于利用更丰富的金属(如铜)来降低成本并提高可及性。这种转变还使反应在更温和的条件下进行,最大限度地减少了有害试剂和溶剂的使用,从而推进了可持续化学的发展。此外,非金属对映选择性有机催化剂(如脯氨酸衍生物)以及采用酶的生物催化剂因其在生产特定对映异构体方面的有效性而受到重视。
生成特异性对映异构体的替代方法包括直接从手性底物进行化学计量合成、将外消旋混合物转化为非镜像的非对映异构体,以及结晶和色谱分离。 这些传统方法可能既昂贵又耗时,通常会产生大量浪费,同时提供次优的产量和对映体纯度。

本白皮书介绍了最近同行评审研究的示例,这些示例展示了梅特勒 托利多技术提供的深入信息和精确控制如何帮助支持四个主题中的绿色和可持续化学:
不对称催化是一种有价值的工具,可以以高效和环保的方式合成高质量的产品。与传统合成方法相比,它有几个优点:
手性或“旋向性”可以引入不对称催化反应中,通过几种不同的机制产生大量的单一立体异构体。 具体机制将取决于特定的反应条件和所用催化剂的类型。最常用的机制包括:
不对称合成是用特定的立体化学技术高产率合成分子的过程。这是化学合成研究的一个关键领域,因为分子的性质和生物活性通常取决于其立体化学。
虽然不对称催化是不对称合成的关键工具,但具有特定立体化学的分子也可以通过手性催化、生物催化或有机催化产生。
手性催化是不对称催化的一个子领域,涉及使用手性催化剂以立体选择性方式促进化学反应。手性催化剂是一种分子,其原子具有特定的空间排列,使其具有旋性或手性。当用于化学反应时,手性催化剂可以与底物相互作用,以高产率产生单一立体异构体。
手性催化的重要性在于许多化学反应会产生立体异构体的混合物,这些立体异构体可以具有不同的性质和生物活性。通过使用手性催化剂,可以选择性地生产单个立体异构体。这种立体异构体可以具有更好的性能和更大的用途。
例如,在制药行业,药物的疗效和安全性通常取决于其立体化学。手性催化可以产生药物的单个立体异构体。这种方法实现了高产量。它提高了药物的治疗潜力。它还降低了副作用的可能性。选择性生产这些化合物 的单一立体异构体的能力可以改善性能。它还可以提高效率并减少浪费。

全面了解反应动力学、机理、催化循环和变量的影响对于优化对映体比率和产物产量以及降低成本和浪费至关重要。
为了获得准确的数据,精确控制温度、压力、反应物加量速率和搅拌速率等基本反应参数至关重要。 自动化实验室反应器 广泛用于学术和工业环境中,以实现这种控制。最近,EasyMax™ 实验室反应器 的功能得到了扩展 ,包括低至 -78 °C 的精确温度控制,这扩大了催化过程的设计空间。
卓越的反应器控制提高了反应测量的准确性,包括分析试剂、反应物、催化剂种类、瞬时中间体和副产物杂质。实时跟踪反应组分可以收集数据丰富的实验,这些实验可以为动力学参数的开发提供信息并支持拟议的反应机制,包括催化循环。
原位实时 FTIR 和拉曼光谱 是更深入地了解催化反应的成熟技术。ReactIR™ 和 ReactRaman™ 光谱仪专为化学反应分析而设计,提供一系列插入式探头和流通池,可以处理催化反应研究通常需要的各种温度和压力。
化学反应 的自动采样通过解决两个尺度的挑战来提高生产率:
EasySampler™ 全自动取样系统是一种自动化反应器取样系统,设计用于反应样品的在线采集、淬灭和稀释。它允许在反应条件下取样,并消除了手动取样过程的挑战。
DirectInject-LC™ 使用色谱测量对化学反应进行原位实时分析。该自动化系统解决了与色谱相关的固有难题,例如反应取样、淬灭、稀释以及与色谱仪的接口。直接进样液相色谱在反应过程中区分和 测量关键物质,从而深入了解反应动力学、机理以及变量对反应结果的影响。DirectInject-LC 与 HPLC-MS、UHPLC 和手性 HPLC 系统连接,可实现先进的分离和分析功能。
在扩大催化反应规模时,化学反应建模的最新进展为更安全、更高产率、杂质更少的反应提供了必要的信息。 实验数据的 动态建模还提供了对反应动力学和反应变量影响的更深入见解。
陈文、程英、张T.、穆英、贾文文、刘国强(2021)。NI/ANTPHOS 催化的 N-1,6-炔烃的立体选择性不对称分子内还原偶联。 有机化学杂志, 86(7),5166-5182。 https://doi.org/10.1021/acs.joc.1c00079
作者报道了从 N-1,6-炔烃酮的不对称镍催化还原偶联合成了一系列含有手性叔烯丙基醇(具有 >99:1 E/Z 立体选择性和 >99:1 er)的吡咯烷。他们使用双(环辛二烯)镍 (0) 和 P-手性单膦配体 [(R)-AntPhos] 和三乙基硅烷作为还原剂来实现这一点。接下来,他们研究了反应机制,重点关注 (R)-AntPhos 如何影响叔烯丙基醇部分的立体选择性和对映选择性。他们提出了一种 N-1,6-炔烃酮与 (R)-AntPhos 不对称还原偶联催化循环的单体金属环状模型,并进行了 原位 FTIR 实验来研究催化循环。
混合 Ni(cod)2 和 (R)-AntPhos 配体的化学计量量,并追踪 1392-1 处的 IR 带,表明 Ni(0) (R)-AntPhos 化合物处于催化循环的第一阶段。随着 N-1,6-炔烃酮的加入,在 1708 cm-1 处出现强酮带,随着炔烃酮在拟议催化循环的第三阶段反应形成 Ni(II) 金属环,该带逐渐减弱。随着 HSiEt3 还原剂的加入,观察到 2092 cm-1 处的条带随着环化叔烯丙基醇的形成而随着时间的推移而减弱。深入的机理检查和 ReactIR 数据使作者能够确定环加成阶段 Ni(II) 金属环决定了对映选择性,而 (R)-AntPhos 配体是关键,因为它提供了一个影响立体化学的笨重的 π 共轭系统。
Sharma, H. A., Essman, J. Z., & Jacobsen, E. N. (2021).对映选择性催化 1,2-硼酸盐重排。 科学, 374(6568),752-757。 https://doi.org/10.1126/science.abm0386
作者评论说,催化可获取的共手性中间体对于合成具有三取代立体中心的多种分子可能很有价值。他们假设通过催化剂对频二氯甲基硼酸盐的对映选择性重排可能导致三取代立体中心。作为模型反应,研究了硼酸锂底物的重排。使用芳基吡咯烷-叔-亮氨酸衍生的硫脲,合成了 ee含量为 48% 的 α-氯硼酯产物。他们发现,当硼酸锂(由二氯甲基硼酸频哪醇酯和正丁基锂)的初始合成过程中存在硫脲时,所得的α-氯硼酯产物表现出 92% 的 ee。
在这项工作之后,开发了一种稳定的异硫脲-硼酸盐预催化剂,当该化合物用 LiHMDS 锂化时, 原位 FTIR (ReactIR) 测量显示异硫脲 N-C-N 带和酰胺 C-O 带均发生显著变化。当加入 HCl 时,这些变化是可逆的。作者假设预催化剂中的 N-H 键是通过螯合过程被 LiHMDS 去质子化的。进行了 DFT 测量并支持观察到的实验 IR 偏移。有了这些信息,作者继续研究了新型硫脲-硼酸锂催化剂系统的范围,该系统用于合成含有 C-C、C-N 和 C-O 键的多种分子,并具有出色的 ee 和产率。
张,Z.,裴,H. Y.,金,J.,拉巴拉科斯,C.,范格梅伦,M.,洛伊茨施,M.,克鲁斯曼,M.,&利斯特,B.(2016)。用于醛的可扩展氰基硅烷化的不对称反阴离子定向路易斯酸有机催化。 自然通讯, 7(1)。 https://doi.org/10.1038/ncomms12478
作者报告开发了一种不对称的路易斯酸催化方法,用于使用三甲基硅烷基氰化物和手性二磺酰亚胺预催化剂对醛进行氰基硅烷化。由于活性高,0.05%-0.005% 的催化剂负载可有效生产所需的氰醇产品。作者报告说,观察到催化剂的非活性期,可以由水可逆地诱导。为了进一步了解这一发展, 使用了原位 FTIR ,并提供了对催化前循环的重要见解。
为了监测醛反应物的浓度,跟踪了 1703 cm-1 羰基带随时间的变化。有趣的是,在一段时间内没有观察到反应,之后转变迅速进行。作者认为休眠期的原因可能与反应混合物中的水有关。通过向反应混合物中加入受控量的水的实验方案,证明水确实是通过水解催化活性物质而缺乏活性的原因。在早期的工作中,甲硅烷基乙烯酮缩醛在二磺酰亚胺催化剂存在下与醛反应,没有观察到休眠期。他们认为这可能是由于甲硅烷基乙烯酮缩醛与预催化剂的高反应性,可立即再生活性路易斯酸催化剂。为了在当前工作中检验这一假设,他们使用催化量的甲硅烷基乙烯酮缩醛作为活化剂,发现避免了休眠期。基于进一步的实验,他们提出了一个反映休眠期的催化前循环。
不对称催化是合成手性分子特异性对映异构体的一种广泛应用的方法。通常,不对称催化涉及含有一个或多个手性配体的有机金属化合物。由于该过程是催化性的,因此少量的手性催化剂会作用于原手性底物,从而产生大量所需的对映异构体。因此,它是生产制药、食品、农用化学品和化妆品行业所需的大量特定对映体化合物的有效方法。
不对称催化在药物、农用化学品和材料等重要化学品的生产以及天然产物的合成中起着重要作用。它能够高效生产对映体纯化合物,这对于药物开发和化学工业中的许多其他应用至关重要。不对称催化可以通过多种机制实现,包括 Lewis 酸碱相互作用、氢键和金属-配体配位。不对称催化中常用的手性催化剂包括手性配体、手性助剂和手性路易斯酸。开发新的、更高效的不对称催化过程是化学研究的一个活跃领域,旨在提高手性合成的效率和选择性。
不对称催化中使用的手性催化剂的例子很多。最常见的是:
不对称催化产物的立体化学由手性催化剂控制。催化剂在反应分子周围诱导手性环境,选择性地有利于一种对映异构体的形成,而不是另一种对映异构体的形成。手性催化剂控制反应立体化学的确切机制取决于催化剂的类型和被催化的反应。