Ван, Ю., Юй, Дж., Ван, Ю., Чен, З., Донг, Л., Цай, Р., Хонг, М., Лонг, Х., и Янг, С. (2020). Шаблонный синтез in situ мезопористого электрокатализатора Ni–Fe для реакции выделения кислорода. RSC Advances, 10(39), 23321–23330. https://doi.org/10.1039/d0ra03111a
В поддержку разработки электрокатализатора ReactRaman предоставляет подробную информацию о связях внутри и на поверхности мезопористого электрокатализатора Ni–Fe.
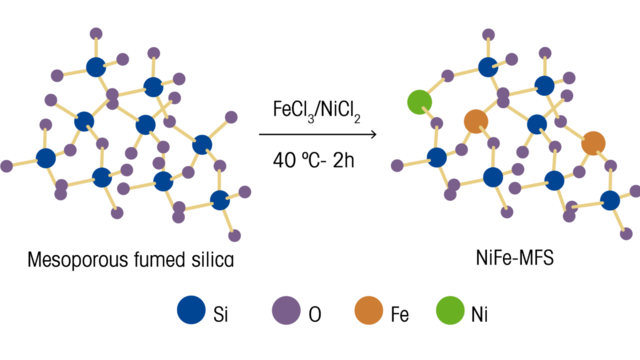
Авторы отмечают важность разработки электрокатализаторов для использования в реакциях выделения кислорода (ООР). Эти электрокатализаторы должны обладать определенными ключевыми характеристиками эффективности, такими как активные центры, которые равномерно распределены и легко доступны по всей поверхности катализатора, при этом являясь экономически эффективными и устойчивыми. Для достижения этих целей они исследовали и разработали метод получения каркаса из мезопористого дымчатого диоксида кремния (MFS), который диспергировал Ni²⁺ и Fe³⁺ с использованием простого подхода. Этот метод использует коммерчески доступную MFS в качестве 3D-опоры для присоединения ионов металлов. Благодаря травлению пропитанной металлом структуры MFS с помощью KOH, полученный электрокатализатор Ni−Fe−O обладает ключевыми характеристиками для ООР, такими как хорошая способность к переносу заряда, большая площадь электрохимической активной поверхности и общая превосходная стабильность.
Синтезирован ряд катализаторов NiFe-MFS с различными молярными соотношениями водных растворов металлов-ионов. Для детального понимания микроструктуры этих электрокатализаторов был использован ряд методов. Это включало в себя просвечивающую электронную микроскопию для исследования наноструктуры, энергодисперсионную рентгеновскую микроскопию для отображения распределения элементов Ni, Fe, Si и O, а также рентгеновскую дифракцию для анализа кристалличности образцов. Морфологию изучали методом эмиссионной сканирующей электронной микроскопии; С помощью рентгеновской фотоэлектронной спектроскопии анализировали энергию связи элемента, а элементный анализ проводили с помощью атомно-эмиссионного спектрометра с индуктивно связанной плазмой. Площадь поверхности и пористость структуры исследовали с помощью адсорбционно-десорбционных измерений газообразного азота.
Связывание металлов Ni/Fe с окуренным кремнеземом было проанализировано и проверено с помощью спектроскопии ReactRman. Для нелегированной MFS наблюдаются полосы на 345–450, 575, 750, 973 и 1070 см⁻¹, возникающие из ряда колебательных связей Si−O−Si и Si−OH. Для образцов, пропитанных высоким содержанием железа, наблюдаются полосы на 332, 495 и 1163 см⁻¹, возникающие в результате изгиба O–Fe–O, изгиба Fe–O–Si и несимметричного растяжения Fe–O–Si соответственно. Эти наблюдения показали, что железо было эффективно включено в решетку кремнезема. Напротив, когда никель был пропитан дымчатым диоксидом кремния, полоса растяжения Si−OH на поверхности 973 см¹ была значительно ослаблена, и никаких дополнительных полос не наблюдалось. Оценка рентгеновских фотоэлектронных и рамановских измерений привела к выводу, что в то время как Fe³⁺ предпочитает встраиваться в каркас дымчатого кремнезема и образует связи Fe–O–Si, Ni²⁺ ковалентно связывается с группами Si–OH на поверхности дымчатого кремнезема.
Был проведен ряд электроаналитических исследований, которые показали важность отношения ионов металлов к производительности, а также то, что связывание Ni и Fe при оптимальном содержании приводит к оптимальной эффективности ООР и улучшению кинетики реакции. Образец 1Ni1Fe-MFS продемонстрировал наибольшую внутреннюю активность ОЭР, в то время как катализатор 2Ni1Fe-MFS имел большую двухслойную емкость и электрохимически активную площадь поверхности. Проведен ряд спектроскопических исследований для определения изменений в катализаторе после ООР. Они показали, что в присутствии КОН Si был вытравлен, обнажая элементы Ni и Fe, которые были активными центрами ООР. Дальнейшая работа показала, что даже после длительной электрической работы катализатор 2Ni1Fe-MFS сохраняет высокую эффективность и стабильность в процессе ОЭР по сравнению с электродами IrO₂ и RuO₂.