Wang, Y., Yu, J., Wang, Y., Chen, Z., Dong, L., Cai, R., Hong, M., Long, X., & Yang, S. (2020). Síntese de modelagem in situ de eletrocatalisador mesoporoso de Ni-Fe para reação de evolução de oxigênio. RSC Avanços, 10(39), 23321–23330. https://doi.org/10.1039/d0ra03111a
Em apoio ao desenvolvimento do eletrocatalisador, o ReactRaman fornece informações detalhadas sobre a ligação dentro e na superfície do eletrocatalisador mesoporoso de Ni-Fe.
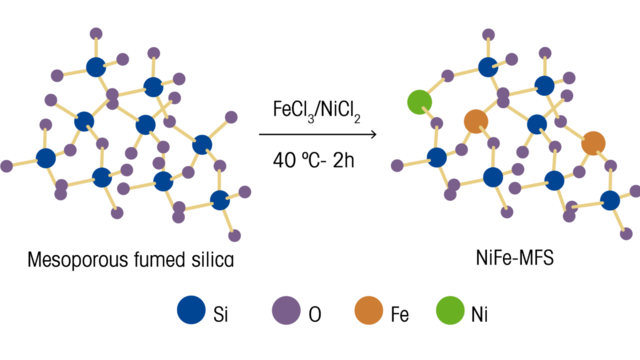
Os autores comentam sobre a importância do desenvolvimento de eletrocatalisadores para uso em reações de evolução de oxigênio (REA). Esses eletrocatalisadores devem ter características-chave de eficiência específicas, como locais ativos que são distribuídos uniformemente e prontamente disponíveis em toda a superfície do catalisador, ao mesmo tempo em que são econômicos e sustentáveis. Para atingir esses objetivos, eles pesquisaram e desenvolveram um método para preparar uma estrutura de sílica pirogênica mesoporosa (MFS) que dispersou Ni²⁺ e Fe³⁺ usando uma abordagem direta. Este método usa MFS disponível comercialmente como um suporte 3D para anexar os íons metálicos. Ao gravar a estrutura impregnada de metal MFS com KOH, o eletrocatalisador Ni−Fe−O formado tem características-chave para REA, como boa capacidade de transferência de carga, grande área de superfície eletroquímica ativa e excelente estabilidade geral.
Uma série de catalisadores NiFe-MFS foram sintetizados com diferentes proporções molares de soluções aquosas de íons metálicos. Uma série de técnicas foi usada para desenvolver uma compreensão detalhada da microestrutura desses eletrocatalisadores. Isso incluiu microscopia eletrônica de transmissão para investigar a nanoestrutura, raios-X por energia dispersiva para mapear a distribuição dos elementos Ni, Fe, Si e O e difração de raios-X para analisar a cristalinidade das amostras. A morfologia foi estudada por microscopia eletrônica de varredura por emissão; A espectroscopia de fotoelétrons de raios-X analisou a energia de ligação do elemento e a análise elementar foi realizada usando um espectrômetro de emissão atômica de plasma indutivamente acoplado. A área superficial e a porosidade da estrutura foram investigadas usando medidas de adsorção-dessorção de gás nitrogênio.
A ligação dos metais Ni/Fe ao suporte de sílica pirogênica foi analisada e verificada com espectroscopia ReactRaman. Para MFS não dopado, são observadas bandas em 345–450, 575, 750, 973 e 1070 cm⁻¹, decorrentes de uma série de ligações vibracionais Si−O−Si e Si−OH. Para amostras impregnadas com alto teor de ferro, são observadas bandas em 332, 495 e 1163 cm⁻¹ decorrentes da flexão O-Fe-O, flexão Fe-O-Si e estiramento assimétrico Fe-O-Si, respectivamente. Essas observações indicaram que o ferro foi efetivamente incorporado à rede de sílica. Em contraste, quando o níquel foi impregnado na sílica pirogênica, a banda de alongamento Si−OH da superfície de 973 cm⁻¹ foi significativamente enfraquecida e nenhuma banda adicional foi observada. A avaliação das medições de fotoelétrons de raios-X e Raman levou à conclusão de que, enquanto Fe³⁺ prefere se inserir na estrutura da sílica pirogênica e forma ligação Fe–O–Si, Ni²⁺ se liga covalentemente com grupos Si−OH na superfície da sílica pirogênica.
Uma série de estudos de eletroanálise foi realizada que mostrou a importância da razão de íons metálicos para o desempenho e que a ligação de Ni e Fe em um conteúdo ideal levou à eficiência ideal de REA e melhorou a cinética de reação. A amostra 1Ni1Fe-MFS demonstrou a maior atividade intrínseca de REA, enquanto o catalisador 2Ni1Fe-MFS teve a maior capacitância de camada dupla e área de superfície eletroquimicamente ativa. Uma série de investigações espectroscópicas foi realizada para determinar as mudanças no catalisador após REA. Eles mostraram que na presença do KOH, o Si foi gravado, expondo os elementos Ni e Fe, que eram os centros ativos REA. Trabalhos posteriores mostraram que, mesmo após operação elétrica de longo prazo, o catalisador 2Ni1Fe-MFS permanece altamente eficiente e estável durante o processo OER, em comparação com os eletrodos IrO₂ e RuO₂.