Vad är biofarmaceutisk nedströmsbearbetning (DSP)?
Nedströmsbearbetning (DSP) är den serie av enhetsoperationer som följer på slutförandet av celltillväxt och expansion och den slutförda produktionen eller syntesen av läkemedelssubstanser eller andra komponenter. Nedströmsbearbetning syftar till att isolera, rena och koncentrera den tidigare syntetiserade läkemedelssubstansen (DS) eller annan produkt från bulkodlingsmatrisen. Historiskt sett har investeringar gjorts för att förbättra avkastningen och titer uppströms, vilket gör utvecklingen av biologiska läkemedel mer ekonomisk. Under tidigare år behandlades inte nedströmsprocesser på samma nivå och kräver nu ytterligare optimering.
Biofarmaceutisk nedströmsbearbetning avser återvinning och rening av ett läkemedelsämne från naturliga källor, såsom djur- eller bakterieceller. Biofarmaceutisk DSP är tillämpbar vid monoklonala antikroppar (mAb) eller proteinprocesser och tillverkning av oligonukleotider, polysackarider, olika vacciner, biokonjugat, genterapier och cellterapiprodukter.
Nedströmsbearbetning kan innefatta inledande formuleringsaktiviteter, vilket innebär övergången från DS till läkemedelsprodukt (DP). Viktiga överväganden inkluderar hantering och mätning av produktkvalitetsattribut, flera processparametrar, källor och mängder av föroreningar, avfallsströmmar och biologiska faror.
DSP-aktiviteter utförs i processutvecklings-, pilot- och tillverkningsskalor i laboratorieskala och med hjälp av processanalytisk teknik (PAT) och MSAT-team (Manufacturing Science and Technology) med fokus på processoptimering, uppskalning och felsökning. Jämförbar nedströmsbearbetning på upptäcktsbiologiska skalor eller tidiga stadier av målscreening med hög genomströmning är inte lika vanligt, även om det kan utföras på liknande sätt. i princip.
6 innovativa tekniker för bioprocesser nedströms
Den här guiden diskuterar hur forskare använder processanalytisk teknik (PAT) för att omvandla dagliga arbetsflöden och avsevärt förbättra processer nedströms. Ämnena inkluderar:
- Övervakning av proteinkoncentration
- Optimering av buffertväxlingsprocessen
- Sammansättning, distribution och morfologi av vaccinadjuvans
- Automatisering av viral inaktivering
- Utveckling av biokonjugeringsprocesser
Vilka är de steg och instrument som är associerade med nedströmsbearbetning?
1. Skörd: Förbehandling, centrifugering och filtrering
- Förbehandling:
Ytaktiv lys, absorption i organisk fas: Produktseparation med lys strävar vanligtvis efter ett grundläggande mål: att effektivt störa de sekvestrerande strukturerna som innehåller läkemedelssubstansen eller produkten och skapa fysisk separation mellan eventuellt skräp, föroreningar och läkemedelssubstansen. Syra- eller ytaktiv lys används nästan uteslutande med bakterie- eller jästkulturer. På samma sätt är absorption och infångning av en produkt i organisk fas vanligast bland bakterieuttryck och produktionssystem och används ibland för jästsystem.
Flockning och utfällning: Dessa är metoder för manipulering av aktiva partikelsystem för att uppnå separationsmålet. Flockning används i allmänhet som en beredningsmetod före filtrering eller centrifugering. Applicering av flockning säkerställer ett högt massflöde över filtreringsenheter samt effektiv och kostnadseffektiv separation av cellmaterial från supernatant. Ytterligare metoder för borttagning av flockningsmedel och verifieringsprotokoll kan krävas. Nederbörd är en aktiv partikelmanipulation som utlöses av ändrade parametrar, såsom lösningsmedel, och jonstyrka för att minska lösligheten. - Centrifugering: Centrifugering är allmänt antagen som en metod för separation inom bioprocesser och är en vanlig och viktig teknik som används för att urskillningslöst separera partikelskräp baserat på massa eller molekylvikt som en funktion av skålens hastighet, fyllnings- och utmatningshastigheter. Vanliga industriella centrifuger avlägsnar betydande mängder (upp till 99 %) av partikelmassan för partikelstorlekar så små som 5 μm, och ibland så små som 1 μm för mycket optimerade processer. Trots denna effektivitet kan centrifuger fortfarande överföra problematiska mängder mikropartiklar, och särskilt nanopartiklar, till nedströmsoperationer som kommer att kräva ytterligare bearbetning. Med bioprocesser som vanligtvis uppnår hög till mycket hög total biomassa (mikro- och nanopartiklar) och varierande slutliga viabla celldensiteter, kan fasta centrifugeringskapaciteter också begränsa processgenomströmningen och anses allmänt inte vara praktiska för kontinuerlig biobearbetning.
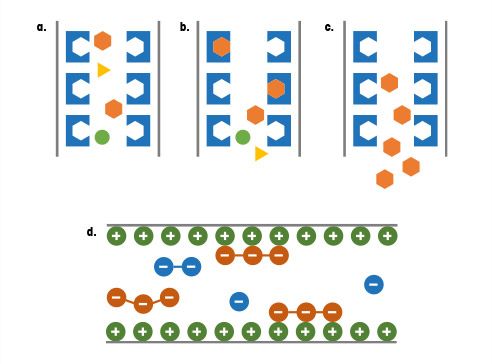
- Djupfiltrering, ihålig fiber: Beroende på produktens och processens karaktär inkluderar skördemetoderna vanligtvis djupfiltrering (fig. 1-1) eller ihåliga fiberfilter (fig. 1-2). Med djupfiltrering pumpas en partikelhaltig blandning genom ett membran eller ett annat gränssnitt för att separera skräp från produkten i flytande suspension. Ihåliga fiberfilter används i kontinuerliga bioprocessoperationer för att avlägsna den supernatant-uttryckta läkemedelssubstansen (DS) samtidigt som en del av biomassan tillfälligt fångas i den ihåliga fibern innan den backspolas med motströmsmedia. Akustisk fält-flödesseparation är en annan framväxande teknik som för närvarande främst finns i utvecklingsmiljöer. Med olika driftsätt och konfigurationer kan resultaten:
- Modulera ingen cell- eller partikelseparation (fig. 1-3a)
- Välj cell- eller partikelseparation från matningsströmmarna till en ny infångningsström med avledning eller separation av en andra partikelpopulation (fig. 1-3b)
- Flytta ett helt partikelsystem till en ny ström och/eller omallokering av vätskor, eventuellt i återcirkulation (fig. 1-3c)
- Interagera hydrodynamiskt, där en modulerad blandning av både partikelselektion och vätskeutbyte kan förekomma (Fig. 1-3d)

Partikelstorleksfördelning (PSD) är känd för att vara en kritisk processparameter (CPP) som är involverad i filterkapaciteten och är mycket mer påverkande än enbart turbiditet och tryck. PSD kan integreras över tid för att kartlägga partikelackumulering på filter (sond ovanför filter) och förutsäga fel. PSD kan också mätas under filtret för att observera genombrott av spårpartiklar och identifiera liknande händelser.
Inline-analysatorer för partikelstorlek, till exempel ParticleTrack™ med FBRM-teknik®, mäter partikelackumulering och storleksfördelning av cellbuljongmatning som går in i eller ut ur filter och kan tillhandahålla kapacitetskorrelation eller återkopplingskontroll för att minimera processstörningar. EasyViewer™ med Image2Chords™ utför bildanalys och extraherar partikelackumulering, storleksfördelning och morfologi från tidsupplösta inline-bilder av processen. Placerad ovanför eller under filter kan EasyViewer ge kapacitetskorrelation eller återkopplingskontroll, men är mest värdefull när den används för grundorsaksanalys, karakterisering och morfologi.
2. Fånga
Metoden och strategin för infångning ändras något beroende på målmolekylens natur. Antikroppar fångas upp av affinitetshartser som protein A och protein G, liksom av vissa andra selektivt konstruerade metoder. Proteiner som inte är antikroppar och oligonukleotider fångas ofta upp med jonbyteskromatografi (IEX). Produkter som polysackarider och komplexa glykanstrukturer fångas ofta upp med hydrofob interaktionskromatografi (HIC) eller omvänd faskromatografi (RPC).
De huvudsakliga mätmålen under kromatografi är att maximera produktens bindningsförmåga till kolonnen, mätt som massan av produkten som lastas på kolonnen (kolonnbelastning), minus massan av den produkt som lämnar kolonnutloppet (känd som "genombrott"). UV är den vanligaste metoden för produktmätning och används i stor utsträckning för protein- och DNA-mätning. Alternativa metoder för produkt- och icke-produktmätningar är också möjliga. Inline FTIR-spektroskopi kan användas för kvantifiering och diskriminering av komponenter såsom ytaktiva ämnen, vanliga socker- eller aminosyrabuffertar, lipider, konjugerade produkter och till och med produkter med variabla konformationsstrukturer, såsom de av fragment-, monomer- eller aggregerade former av mAbs. FTIR används oftast som tillägg till UV när enbart UV inte kan mäta viktiga icke-protein-/icke-nukleinsyrakomponenter.
- Affinitetskromatografi (protein A/G) är en första-passage-kromatografisk metod (vanligtvis kallad protein A eller ProA) som separerar och koncentrerar produkten av intresse (vanligtvis en mAb) från andra lösliga material genom att reversibelt binda eller behålla målproteinet till kolonnen via specifika bindningsinteraktioner (bild a) medan de andra komponenterna "elueras" genom kolonnen (bild b). En selektiv eluering följer en serie tvättsteg och frigör sedan målmolekylen (bild c).
- Jonbyteskromatografi (IEX) separerar och koncentrerar den intressanta produkten (proteiner, oligonukleotider och andra) från andra lösliga material genom att reversibelt binda eller behålla målmolekylen till kolonnen baserat på styrkan i den elektrostatiska interaktionen med fastfasmaterialet (fig. 2d) medan de andra komponenterna "elueras" genom kolonnen. IEX används regelbundet som en extra eller alternativ reningsmetod och är därför inte begränsad till fångstapplikationer.
Provtagningshastigheten och detektionsgränsen (LoD) med in-situ FTIR-spektrometrar som ReactIR™ är fördelaktiga för primär infångningskromatografi, som registrerar flera mätpunkter inom snabbt eluerande toppar eller fraktioner samtidigt som flera komponenter differentieras kvantitativt. Inline FTIR-spektroskopi gör det möjligt för användare att övervaka variabla matningar, såväl som hartskvalitet och livstidsprestanda, identifiera och fingeravtryckseluera komponenter och eliminera förseningar i mottagandet av analysresultat för att fatta datadrivna beslut i realtid.
3. Buffertutbyte och uppkoncentrering
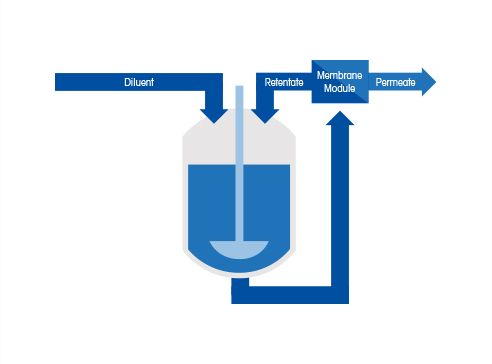
Ultrafiltrering (UF) används ofta i nedströms bioprocesser för att koncentrera en utspädd produktström. Ultrafiltrering separerar molekyler i en lösning baserat på membranets porstorlek eller molekylviktsgräns. Diafiltrering (DF) används oftast för att byta ut produkten till en önskad buffert (t.ex. från en elueringsbuffert till en slutlig formuleringsbuffert).
Ultrafiltrering och diafiltrering (tillsammans känd som buffertutbyte) använder vanligtvis tangentiell flödesfiltrering (TFF), där matningen flödar parallellt med membranytan snarare än vinkelrätt mot ytan (fig. 3). Buffertutbyte är fortfarande en mycket manuell operation som sällan optimeras. Produktkoncentrationer analyseras i allmänhet med en form av UV-spektroskopi, antingen fristående, som en detektor för HPLC eller som en metod med variabel väglängd.
Flera utmaningar uppstår i processen för buffertutbyte:
- Exakt spårning av växlingsvolymer
- Säker processförutsägelse från icke-representativa fångstprover
- Fördröjda eller flaskhalsade svarstider för offlinemätningar
- Kumulativ produktförlust med extraktiv provtagning
- Utbredning av fel vid provberedning för offline UV- och HPLC-mätningar
In-situ infraröd och Raman-spektroskopi gör det möjligt att analysera flera komponenter samtidigt, med större precision och dynamiskt omfång, och utan de fördröjningar som är förknippade med offlineanalys. In-situ FTIR-spektroskopi med ReactIR kan erbjuda många fördelar vid buffertutbyte:
- Kvantifiera flera hjälpämnen och läkemedelssubstanser (DS) samtidigt i realtid
- Kontrollera användningen av buffert
- Övervaka membraneffekter
- Använd direkt in-situ koncentration i stället för diavolymapproximationer
- Öka koncentrationsnoggrannheten från +/-5 % till +/-2 %
- Eliminera analytiska förseningar
Automatiserade reaktorer som EasyMax™ påskyndar processutvecklingen med upp till 80 % genom insamling av experimentella data, noggrann kontroll av alla kritiska processparametrar (CPP) och integrering av biofysiska sensorer inklusive pH, konduktivitet, redox och upplöst syre (DO).

4. Rening (och rensning av föroreningar eller föroreningar)
Det finns flera metoder som används i sekvens som används för att öka renheten hos läkemedelssubstansen (DS). Börjar med tidiga renings- och extraktionssteg, följt av en lämplig metod för avskiljning och första bulkisolering, därefter följt av mellanliggande och sedan slutliga reningssteg, varav det senare inkluderar polering, kromatografi, nano/steril filtrering, kristallisation och viral clearance (fig. 4).
Genom att eliminera förseningar i samband med offlineanalys förbättrar in-situ FTIR-mätningar poleringskromatografistegen genom att ge omedelbar återkoppling för att kvantifiera och specificera fraktionskomponenter inklusive buffertar, läkemedelssubstanser och föroreningar under mellanliggande reningssteg. Detta resulterar i förbättrade fraktionsskärningar, diskriminering av aggregat eller fragment och total koncentration i realtid.
För viral eliminering är alla virus som finns i den poolade och halvrenade terapeutiska suspensionen avsiktligt skadade eller abrupt missbildade till en icke-patogen form, vanligtvis genom att miljön runt viruset förändras. Styrning och förfining av dessa kritiska processparametrar (CPP) möjliggörs av automatiserade reaktorplattformar med integrerade biofysiska sensorer. Inline processanalytisk teknik (PAT) är användbar för att karakterisera föroreningar i senare steg av rening eftersom koncentrationerna i allmänhet är högre och det är lättare att urskilja produkter i en halvrenad matris.
5. Biokonjugering (molekylberoende)
Biokonjugerade molekyler är utformade för att ha en ökad effekt som möjliggörs av den kombinerade funktionen av två eller flera olika terapeutiska typer av molekyler. Biokonjugatkemi kräver detaljerad processkarakterisering och optimering. Konventionella verktyg som mikrocentrifugrör, bägare, värmeplattor, magnetiska omrörare och överföringspipetter kan inte längre uppfylla reproducerbarhetskraven kring pH, temperatur, dosering, blandning och andra parametrar.
Biokonjugeringskemi bygger på en serie välkontrollerade steg i sekvens som kan inkludera funktionell gruppreduktion, aktivering, API-länkkonjugering till det primära biologiska läkemedlet och valfritt antal tvätt-, lösningsmedels- eller buffertbytessteg (fig. 5). Biofarmaceutiska forskare använder teknik som redan används i stor utsträckning inom forskning och utveckling av små molekyler, till exempel EasyMax automatiserade syntesreaktorer. EasyMax tillhandahåller en sammanhängande arkitektur så att relevanta processparametrar inklusive pH, konduktivitet, redox, temperatur, omrörning, dosering, etc., kontrolleras exakt och experimentella data fångas exakt. Automatisering av biokonjugeringskemi ger dataintegration, korrelation mellan processhändelser, experimentell integritet och uppskalningsparametrar för Design of Experiment (DoE).
EasyMax möjliggör snabb bedömning och finjustering av CPP-utrymmet för DoE, inklusive blandningsförhållanden, temperaturkontroll, doseringsstrategier och doser. Eliminera experimentell variabilitet som är förknippad med offline, manuella metoder och dåliga kritiska processparameterkontroller. In-situ FTIR och Raman-spektroskopi kan ge detaljerad mekanistisk information i realtid, vilket eliminerar offlinefördröjningar och provtagningsfel.


6. Formulering
Målet med formuleringen är att överföra produktmolekylen från en miljö, lösningsmedel eller annat fysiskt tillstånd som används för att syntetisera produkten till en form som är acceptabel för klinisk administrering på människa (fig. 6). Produktmolekylen är formulerad efter hur slutprodukten kommer att användas via inandning, injektion eller oral dosering. Långtidsstabiliteten hos produkten och tillhörande hjälpämnen bedöms för att säkerställa att den uppmätta dosen och de kritiska kvalitetsattributen (CQA) ligger inom specifikationen efter bearbetning, lagring och transport. Förutom sterilitet är det viktigt att säkerställa avlägsnandet av föroreningar och endotoxiner och förhindra nedbrytning av läkemedelsprodukter (DP) för att upprätthålla säkerhet och effektivitet under tillverkning och långtidslagring av ett terapeutiskt protein.
Formulerade läkemedelsprodukter inkluderar proteiner (specifikt mAb), polysackarider, nanopartikelsystem, organiska ämnen, oligonukleotider, genterapier och många typer av vacciner. Vissa vacciner kommer att formuleras med ett adjuvans, vanligtvis en aluminiumbaserad partikel eller en organisk emulsion. Vaccinformulering och adjuvanssyntes, i synnerhet, är arbetsflöden som är väl positionerade för att dra nytta av automatiserade arbetsstationer med parallella reaktorer, digitalisering av arbetsflöden och ortogonal processanalytisk teknik (PAT) integration. Med PAT i realtid får man mycket mer kunskap om processen, snarare än att bara analysera start- och slutpunkterna.
Parallella reaktorsystem som EasyMax kontrollerar alla kritiska processparametrar och integrerar inbyggda PAT-verktyg som ReactIR, ReactRaman™, ParticleTrack, EasyViewer, bland andra biofysiska sensorer. Dessa tekniker används ofta i formuleringar för att karakterisera läkemedelssubstans och läkemedelsproduktstabilitet, slutlig koncentration, adjuvanssyntes, polymerisationer, inkapsling, adsorptioner och andra partikelhändelser.
Ytterligare resurser
Relaterade produkter
Citat och referenser
Utvald publikation: Zinkkloridutfällning för att fånga upp rekombinanta antikroppar
EasyMax och ParticleTrack stöder rening
Dutra, G., Komuczki, D., Jungbauer, A., & Satzer, P. (2020). Kontinuerlig infångning av rekombinanta antikroppar genom ZnCl2-utfällning utan polyetylenglykol. Teknik inom biovetenskap, 20(7), 265–274. https://doi.org/10.1002/elsc.201900160
Författarna rapporterar att de använder tvåvärda katjoner, specifikt ZnCl2, för att fånga och rena monoklonala antikroppar i en utfällningsbaserad metod. På grund av tvärbindningskaraktären hos divalenta katjoner och eliminering av PEG var viskositeten från supernatanten och spädningsfaktorerna för återlöslighet mycket låga.
Genom att hålla ZnCl2-koncentrationen statisk och variera pH med hjälp av en EasyMax automatiserad laboratoriereaktor kvantifierade författarna effekten av pH på avkastningen. Nederbörden övervakades med en ParticleTrack FBRM-sond och storleksfördelningen av proteinkluster mättes vid de olika pH-värdena. De fann att det optimala pH-värdet för nederbörden ligger runt pH 6 och 7, och att pH har en stor inverkan på storleken på fällklustren, där de största klustren är förknippade med bättre avkastning. De uppger att FBRM inline-övervakning kan användas för att uppskatta de resulterande avkastningarna utan offlinemätning av den faktiska koncentrationen under nederbörd.
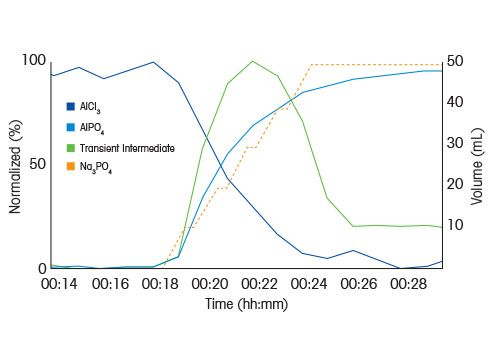
Utvald publikation: Fysikalisk-kemisk undersökning av aluminiumfosfatadjuvans
EasyMax-plattformen integrerar in-situ spektroskopi och partikelkarakterisering
Mei, C., Deshmukh, S. S., Cronin, J. T., Cong, S., Chapman, D. P., Lazaris, N., Sampaleanu, L., Schacht, U., Drolet-Vives, K., Ore, M. O., Morin, S., Carpick, B., Balmer, M. T., & Kirkitadze, M. (2019). Aluminiumfosfat vaccinadjuvans: Analys av sammansättning och storlek med hjälp av Off-Line och In-Line verktyg. Computational and Structural Biotechnology Journal, 17, 1184–1194. https://doi.org/10.1016/j.csbj.2019.08.003
Eftersom interaktionen mellan antigenet och adjuvans är viktig för vaccinets immunogenicitet, undersökte författarna de fysikalisk-kemiska egenskaperna hos adjuvansen, i detta fall AlPO4, såsom partikelstorlek och kemisk sammansättning. De använde både offline-tekniker som Fourier-Transform Infrared (FTIR) och Raman-spektroskopi, röntgenfotoelektronspektroskopi (XPS), laserdiffraktion och inline-metoder inklusive in-situ ATR-FTIR-spektroskopi (ReactIR), Raman-spektroskopi (ReactRaman) och Focused Beam Reflectance Measurement (FBRM, ParticleTrack). Med avseende på inline-mätningarna undersöktes partikelstorleksfördelningen av aluminiumfosfat och adsorberat protein med FBRM, och sammansättningsanalys av aluminiumfosfat utfördes med hjälp av in-situ ATR-sonden.
Författarna drog slutsatsen att inline PAT effektivt övervakar partikelstorlek och kemisk sammansättning för de olika stegen i adjuvanstillverkningen. Liknande tillvägagångssätt kan också användas för att bedöma konsistens från parti till parti. De uppger att användningen av inline PAT stöder avancerade tillverkningsstrategier, t.ex. testning av produktlanseringar i realtid.
Nedströmsbearbetning i referentgranskade publikationer
Nedan följer ett urval av de senaste publikationerna med nedströmsbearbetning inom bioteknik och biofarmaceutisk industri.
- Garg, M., & Rathore, A. S. (2023). Tillämpning av PAT vid farmaceutisk tillverkning: modellbaserad kontroll av partikelstorleksfördelning vid anti-lösningsmedelsstödd kristallisation. Tidskrift för kemisk teknik och bioteknik, 98 (12), 2806–2811. https://doi.org/10.1002/jctb.7497
- Dutra, G., Komuczki, D., Jungbauer, A., & Satzer, P. (2020). Kontinuerlig infångning av rekombinanta antikroppar genom ZnCl2-utfällning utan polyetylenglykol. Teknik inom biovetenskap,20(7), 265–274. https://doi.org/10.1002/elsc.201900160
- Wasalathanthri, D. P., Rehmann, M. S., Song, Y., Gu, Y., Luo, M., Shao, C., Chemmalil, L., Lee, J., Ghose, S., Borys, M., Ding, J., & Li, Z. J. (2020). Teknikutsikter för övervakning av kvalitetsattribut och processparametrar i realtid inom biofarmaceutisk utveckling – En översikt. Bioteknik och bioteknik, 117(10), 3182–3198. https://doi.org/10.1002/bit.27461
- Mei, C., Deshmukh, S. S., Cronin, J. T., Cong, S., Chapman, D. P., Lazaris, N., Sampaleanu, L., Schacht, U., Drolet-Vives, K., Ore, M. O., Morin, S., Carpick, B., Balmer, M. T., & Kirkitadze, M. (2019). Aluminiumfosfatvaccinadjuvans: Analys av sammansättning och storlek med hjälp av Off-Line och In-Line verktyg. Computational and Structural Biotechnology Journal, 17, 1184–1194. https://doi.org/10.1016/j.csbj.2019.08.003
- Kager, J., Berezhinskiy, V., Zimmerleiter, R., Brandstetter, M., & Herwig, C. (2019). Utvidgning av ett partikelfilter för uppskattning av bioprocesstillstånd med hjälp av invasiva och icke-invasiva IR-mätningar. I Datorstödd kemiteknik (pp. 1417–1422). https://doi.org/10.1016/b978-0-12-818634-3.50237-x
- Brunner, M., Brosig, P., Losing, M., Kunzelmann, M., Calvet, A., Stiefel, F., Bechmann, J., Unsoeld, A., & Schaub, J. (2019). Mot robusta cellodlingsprocesser - Att reda ut effekterna av medieförberedelse genom spektroskopisk onlineövervakning. Teknik inom biovetenskap, 19(10), 666–680. https://doi.org/10.1002/elsc.201900050
- Deshors, M., Guais, O., Neugnot-Roux, V., Cameleyre, X., Fillaudeau, L., & François, J. (2019). Kombinerade in situ fysiska och ex-situ biokemiska metoder för att undersöka in vitro dekonstruktion av destarched vetekli med enzymcocktail som används i djurfoder. Gränser inom bioteknik och bioteknik, 7. https://doi.org/10.3389/fbioe.2019.00158
- Großhans, S., Rüdt, M., Sanden, A., Brestrich, N., Morgenstern, J., Heißler, S., & Hubbuch, J. (2018). In-line Fourier-transform infraröd spektroskopi som en mångsidig processanalytisk teknik för preparativ proteinkromatografi. Tidskrift för kromatografi A, 1547, 37–44. https://doi.org/10.1016/j.chroma.2018.03.005
- Lemoine, A., Delvigne, F., Bockisch, A., Neubauer, P., & Junne, S. (2017). Verktyg för bestämning av populationsheterogenitet orsakad av inhomogena odlingsförhållanden. Tidskrift för bioteknik, 251, 84-93. https://doi.org/10.1016/j.jbiotec.2017.03.020
- Dirksen, A., Davis, K. A., Collins, J., Bhattacharya, K., Finneman, J. I., Pepin, E. L., Ryczek, J. S., Brown, P., Wellborn, W. B., Mangalathillam, R., Evans, B., Pozzo, M. J., & Finn, R. F. (2017). Processutveckling av ett FGF21 protein-antikroppskonjugat. Peptidvetenskap, 110(1). https://doi.org/10.1002/bip.23042
- Koch, C., Posch, A. E., Herwig, C., & Lendl, B. (2016). Jämförelse av fiberoptik och ledning Attenuated Total Reflection (ATR) fourier Transform Infrared (FT-IR) setup för In-Line jäsningsövervakning. Tillämpad spektroskopi, 70(12), 1965–1973. https://doi.org/10.1177/0003702816662618
- Salazar, A., Bleifuß, J., Simon, A., Schüßler, S., Keusgen, M., Stankiewicz, N. R., & Von Hagen, J. (2016). Komprimering av kemiskt definierade cellodlingsmedier ökar dess upplösningshastighet genom en ökning av ytan som är tillgänglig för lösningsmedlet. Pulverteknologi, 301, 110–117. https://doi.org/10.1016/j.powtec.2016.05.065
- Lopez-Exposito, P., Suárez, Á. B., & Negro, C. (2015). Uppskattning av koncentration av biomassa för Chlamydomonas reinhardtii från data om fördelning av ackordlängder. Tidskrift för tillämpad fykologi, 28(4), 2315–2322. https://doi.org/10.1007/s10811-015-0749-4
- Sieblist, C., Jenzsch, M., & Pohlscheidt, M. (2015). Karakterisering av utrustning för att minska risker vid överföring av tillverkningsprocesser för cellkulturer. Cytoteknologi, 68(4), 1381–1401. https://doi.org/10.1007/s10616-015-9899-0
- Fagaschewski, J., Sellin, D., Wiedenhöfer, C., Bohne, S., Trieu, H. K., & Hilterhaus, L. (2015). Rumsligt upplöst in situ bestämning av reaktionsförlopp med hjälp av mikrofluidiksystem och FT-IR-spektroskopi som ett verktyg för biokatalytisk processutveckling. Bioprocess- och biosystemteknik, 38(7), 1399–1405. https://doi.org/10.1007/s00449-015-1381-z
- Wu, H., Read, E. K., White, M., Chavez, B., Brorson, K., Agarabi, C., & Khan, M. A. (2015). Realtidsövervakning av bioreaktor mAb IgG3 cellkulturprocessdynamik via Fouriertransform infraröd spektroskopi: Implikationer för att möjliggöra analysteknik för cellodlingsprocesser. Gränser för kemivetenskap och teknik, 9 (3), 386–406. https://doi.org/10.1007/s11705-015-1533-3
- Koch, C., Posch, A. E., Goicoechea, H. C., Herwig, C., & Lendl, B. (2014). Multianalytkvantifiering i bioprocesser med Fourier-transform-infraröd spektroskopi med partiell minstakvadratregression och multivariat kurvupplösning. Analytica Chimica Acta, 807, 103–110. https://doi.org/10.1016/j.aca.2013.10.042
- Walther, C., Mayer, S., Jungbauer, A., & Dürauer, A. (2014). Gör dig redo för PAT: Uppskalning och inline-övervakning av proteinveckning av Npro-fusionsproteiner. Processbiokemi, 49(7), 1113–1121. https://doi.org/10.1016/j.procbio.2014.03.022
- Tscheließnig, A., Satzer, P., Hammerschmidt, N., Schulz, H., Helk, B., & Jungbauer, A. (2014). Etanolutfällning för rening av rekombinanta antikroppar. Tidskrift för bioteknik, 188, 17–28. https://doi.org/10.1016/j.jbiotec.2014.07.436
- Sagmeister, P., Kment, M., Wechselberger, P., Meitz, A., Langemann, T., & Herwig, C. (2013). Soft-sensor assisterad dynamisk undersökning av bioprocesser med blandat foder. Processbiokemi, 48(12), 1839–1847. https://doi.org/10.1016/j.procbio.2013.09.018
- Sagmeister, P., Langemann, T., Wechselberger, P., Meitz, A., & Herwig, C. (2013). En dynamisk metod för undersökning av inducerade tillstånds metaboliska kapacitet som en funktion av temperatur. Mikrobiella cellfabriker, 12(1). https://doi.org/10.1186/1475-2859-12-94
- Dahlbacka, J., Kiviharju, K., Eerikäinen, T., & Fagervik, K. (2012). Övervakning av Streptomyces peucetius-odlingar med hjälp av FTIR/ATR-spektroskopi och kvantitativa modeller baserade på bibliotekstypdata. Biotechnology Letters, 35(3), 337–343. https://doi.org/10.1007/s10529-012-1093-2
- Dahlbacka, J., Weegar, J., von Weymarn, N., & Fagervik, K. (2012). On-line mätning av substratkoncentrationerna i Pichia pastoris-fermenteringar med hjälp av FT-IR/ATR. Biotechnology Letters, 34(6), 1009–1017. https://doi.org/10.1007/s10529-012-0868-9
- Landgrebe, D., Haake, C., Höpfner, T., Beutel, S., Hitzmann, B., Scheper, T., Rhiel, M., & Reardon, K. F. (2010). On-line infraröd spektroskopi för bioprocessövervakning. Tillämpad mikrobiologi och bioteknik, 88(1), 11–22. https://doi.org/10.1007/s00253-010-2743-8
- Dabros, M., Schuler, M. M., & Marison, I. W. (2010). Enkel kontroll av specifik tillväxthastighet i bioteknologiska Fed-batch-processer baserat på förbättrade onlinemätningar av biomassa. Bioprocess- och biosystemteknik, 33(9), 1109–1118. https://doi.org/10.1007/s00449-010-0438-2
- Müller, J., Neumann, M., Scholl, P., Hilterhaus, L., Eckstein, M., Thum, O., & Liese, A. (2010). Onlineövervakning av biotransformationer i högviskösa flerfassystem med hjälp av FT-IR och kemometri. Analytisk kemi, 82(14), 6008–6014. https://doi.org/10.1021/ac100469t