分析反應動力學使科學家能夠對失控反應場景進行建模並建立理想的反應程序。測量、計算和理解以下參數對於評估和避免化學過程中的風險至關重要。這使科學家能夠對溫度和劑量曲線、濃度或最高工作溫度進行預測。從熱化學的角度來看,關鍵信息是:
1. 累積
2. 絕熱溫升
3. 熱容量
4. 反應焓
5. 產熱速率/反應熱
6. MTSR(合成反應的最高溫度)
7. 期望反應、 不良 反應、分解、熱失控

分析反應動力學使科學家能夠對失控反應場景進行建模並建立理想的反應程序。測量、計算和理解以下參數對於評估和避免化學過程中的風險至關重要。這使科學家能夠對溫度和劑量曲線、濃度或最高工作溫度進行預測。從熱化學的角度來看,關鍵信息是:
1. 累積
2. 絕熱溫升
3. 熱容量
4. 反應焓
5. 產熱速率/反應熱
6. MTSR(合成反應的最高溫度)
7. 期望反應、 不良 反應、分解、熱失控
絕熱溫升是針對任何給定反應計算的屬性,用於指示冷卻故障或其他製程故障的潛在嚴重程度。它取決於釋放的能量總量(反應焓)、反應混合物的總質量以及系統的比熱容。了解它是否可以將反應混合物帶到可能發生二次反應或分解反應的溫度尤為重要。絕熱溫升可以使用 反應量熱儀 輕鬆計算,以給出溫度升高的簡單“最壞情況”指示。更複雜的計算,例如 由iC Safety執行的計算,可以得出相關參數,例如MTSR(合成反應的最高溫度),這是放大研究更有用的參數。
材料的熱容或比熱容描述了將一公斤材料的溫度升高攝氏一度所需的能量。因此,熱容的標準單位是 kJ/kg。K-1。該性質在累積熱量、絕熱溫升和 MTSR 的計算中起直接作用。由於它根據反應器內容物的性質而變化,因此有必要通過實驗確定混合物的熱容,作為工藝安全研究的一部分。這帶來了額外的好處,即此類數據通常受到從事放大工作的工程師的歡迎,因為它有助於計算過程的整體能量平衡。
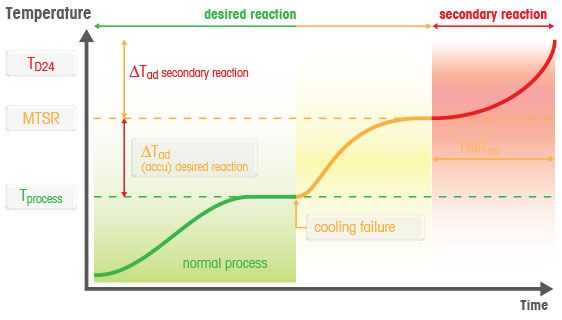
合成反應的最高溫度(MTSR)是半間歇式反應器化學 過程安全的 基石之一。它描述了由於冷卻失效時存在的未反應材料量而導致的冷卻失效後溫度變化。從製程溫度開始,動態執行 MTSR 的計算,以確定所有反應能量都保留在反應器中(即系統絕熱或變為絕熱),反應混合物將達到的最高溫度。 反應量熱儀 是測量 反應熱、試劑積累和MTSR的重要工具。值得注意的是,此特性僅涉及所需的(合成)反應,並且需要執行其他程序(差示掃描量熱法,DSC)以了解任何後續二次反應或分解反應的影響。

熱失控或熱爆炸可能是反應或一系列反應絕熱過程的結果。當放熱反應產生的熱量積累導致反應混合物溫度升高時,就會發生這種情況。隨後,反應速率增加,導致發熱速率增加。
溫度升高可能會引發二次反應,例如反應物質、中間體或最終產物的分解,導致熱失控。透過在實驗室規模上進行適當的製程安全研究,可以在製程擴大規模之前識別並避免導致熱失控的條件。
研究兩者,期望和潛在不想要的反應至關重要。雖然使用絕熱量熱儀、杜瓦瓶或 DSC 研究不需要的反應,但通常使用 反應量熱儀來研究所需的反應。
反應量熱儀可用於確定反應熱、累積、絕熱溫升和MTSR等關鍵因素,以了解冷卻故障的後果。事實上,它用於確定所需的合成反應是否會導致過程變得不穩定,從而導致二次反應。
在大多數情況下,二次反應釋放的能量比所需的反應更快,生產設施無法安全地去除這種能量。因此,有必要設計反應,以免發生潛在的危險情況,或定義適當的措施以確保過程始終處於安全控制之下。