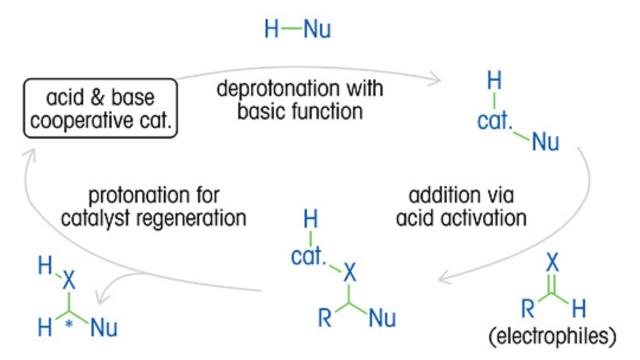
Una comprensione approfondita della cinetica di reazione, del meccanismo, dei cicli catalitici e dell'impatto delle variabili è essenziale per ottimizzare i rapporti enantiomerici e la resa del prodotto, oltre a ridurre i costi e gli sprechi.
Per ottenere dati accurati, è fondamentale un controllo preciso dei parametri fondamentali della reazione come la temperatura, la pressione, la velocità di dosaggio del reagente e la velocità di agitazione. I reattori da laboratorio automatizzati sono ampiamente utilizzati in ambienti accademici e industriali per ottenere questo controllo. La recente espansione delle capacità del reattore da laboratorio EasyMax™ per includere un controllo preciso della temperatura fino a -78 °C amplia lo spazio di progettazione per i processi catalitici.
Il controllo superiore del reattore migliora l'accuratezza delle misure di reazione, compresa l'analisi di reagenti, reagenti, specie di catalizzatori, intermedi transitori e impurità di sottoprodotti. Il monitoraggio in tempo reale delle specie di reazione consente la raccolta di esperimenti ricchi di dati che possono informare lo sviluppo di parametri cinetici e supportare i meccanismi di reazione proposti, compresi i cicli catalitici.
La spettroscopia FTIR e Raman in situ e in tempo reale sono tecniche consolidate per ottenere una comprensione più approfondita delle reazioni catalitiche. Gli spettrometri ReactIR™ e ReactRaman sono stati progettati per l'analisi™ delle reazioni chimiche, offrendo una gamma di sonde a inserzione e celle di flusso in grado di gestire l'ampia gamma di temperature e pressioni spesso richieste per le indagini sulle reazioni catalitiche.
Il campionamento automatizzato delle reazioni chimiche consente di aumentare la produttività affrontando le sfide su due scale:
- Strumenti di campionamento manuali, come pipette e siringhe
- Il processo di campionamento manuale stesso, con reazioni impegnative sensibili alla temperatura, alla pressione o all'aria
EasySampler™ è un sistema di campionamento automatizzato per reattori progettato per l'acquisizione, il quenching e la diluizione in linea di campioni di reazione. Consente di recuperare i campioni in condizioni di reazione ed elimina le sfide del processo di campionamento manuale.
DirectInject-LC™ fornisce analisi in situ e in tempo reale delle reazioni chimiche utilizzando misure cromatografiche. Il sistema automatizzato affronta le difficili questioni intrinseche associate alla cromatografia, come il campionamento della reazione, il quenching, la diluizione e l'interfacciamento con il cromatografo. DirectInject-LC differenzia e misura le specie chiave man mano che la reazione procede, ottenendo una comprensione approfondita della cinetica di reazione, del meccanismo e dell'effetto delle variabili sull'esito della reazione. DirectInject-LC si interfaccia con i sistemi HPLC-MS, UHPLC e HPLC chirali per una capacità avanzata di separazione e analisi.
Per quanto riguarda l'aumento di scala delle reazioni catalitiche, i recenti progressi nella modellazione delle reazioni chimiche forniscono le informazioni necessarie per reazioni più sicure e ad alto rendimento con meno impurità. La modellazione dinamica dei dati sperimentali offre anche informazioni più approfondite sulla cinetica di reazione e sull'effetto delle variabili di reazione.