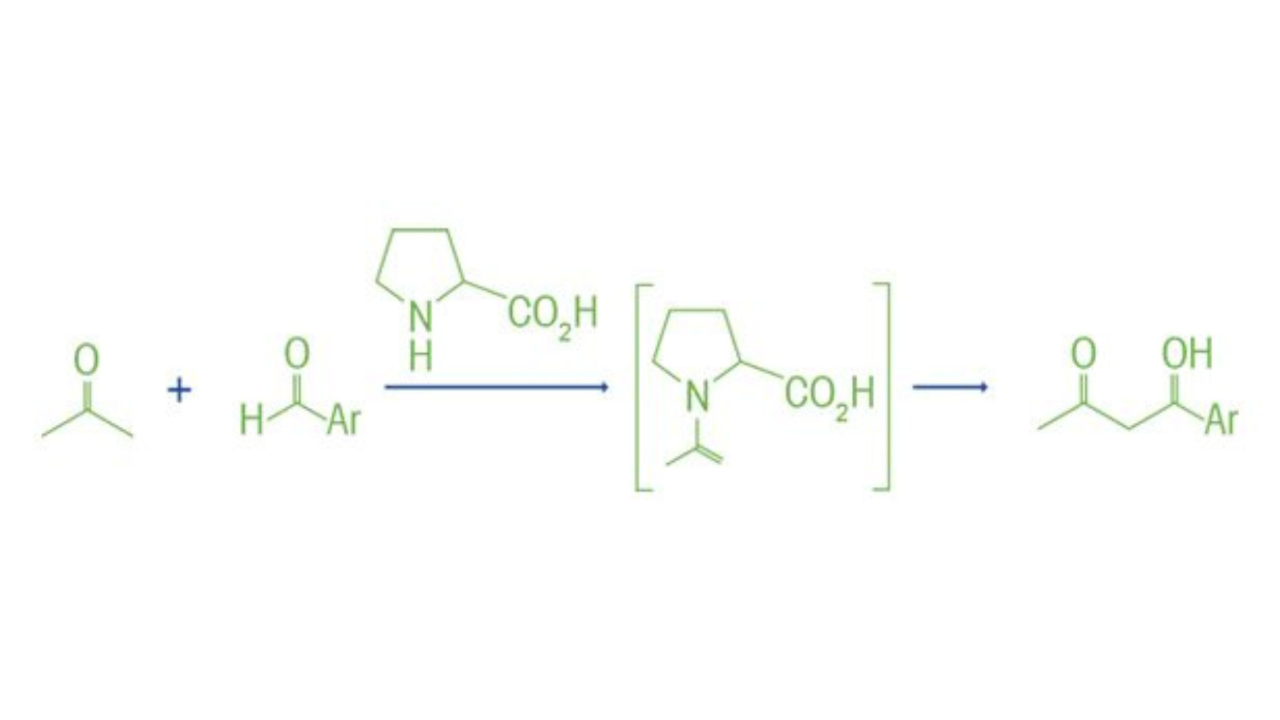
Zhang, Z., Bae, H. Y., Guin, J., Rabalakos, C., Van Gemmeren, M., Leutzsch, M., Klussmann, M., & List, B. (2016). Asymmetrische Gegenanionen-gerichtete Lewis-Säure-Organokatalyse zur skalierbaren Cyanosilylierung von Aldehyden. Nature Communications, 7(1). https://doi.org/10.1038/ncomms12478
Die Autoren berichten über die Entwicklung einer asymmetrischen Lewis-Säure-Organokatalysemethode zur Cyanosilylierung von Aldehyden unter Verwendung von Trimethylsilylcyanid und einem chiralen Disulfonimid-Vorkatalysator. Aufgrund der hohen Aktivität waren Katalysatorbeladungen von 0,05 % bis 0,005 % effektiv bei der Herstellung des gewünschten Cyanohydrinprodukts. Die Autoren berichten, dass eine inaktive Periode des Katalysators beobachtet wird, die reversibel durch Wasser induziert werden kann. In-situ FTIR wurde verwendet, um diese Entwicklung besser zu verstehen und lieferte wichtige Einblicke in den präkatalytischen Zyklus.
Um die Konzentration des Aldehydreaktanten zu überwachen, wurde die 1703 cm-1 Carbonylbande über die Zeit verfolgt. Interessanterweise wurde eine Zeit lang keine Reaktion beobachtet, danach verlief die Transformation recht schnell. Die Autoren vermuteten, dass der Grund für die Ruhephase mit Wasser im Reaktionsgemisch zusammenhängen könnte, und ein experimentelles Protokoll der Zugabe kontrollierter Mengen Wasser zum Reaktionsgemisch bewies, dass Wasser tatsächlich für die mangelnde Aktivität durch Hydrolyse der katalytisch aktiven Spezies verantwortlich war. In früheren Arbeiten, in denen ein Silylketenacetal in Gegenwart eines Disulfonimid-Katalysators mit einem Aldehyd umgesetzt wurde, wurde keine Ruhephase beobachtet. Sie vermuteten, dass dies auf die hohe Reaktivität des Silylketenacetals mit dem Präkatalysator zurückzuführen sein könnte, wodurch der aktive Lewis-Säure-Organokatalysator sofort regeneriert wurde. Um diese Hypothese in der aktuellen Arbeit zu testen, verwendeten sie eine katalytische Menge an Silylketenacetal als Aktivator und stellten fest, dass die Ruhephase vermieden wurde. Basierend auf weiteren Experimenten schlugen sie einen präkatalytischen Zyklus vor, der die Ruhephase widerspiegelt.