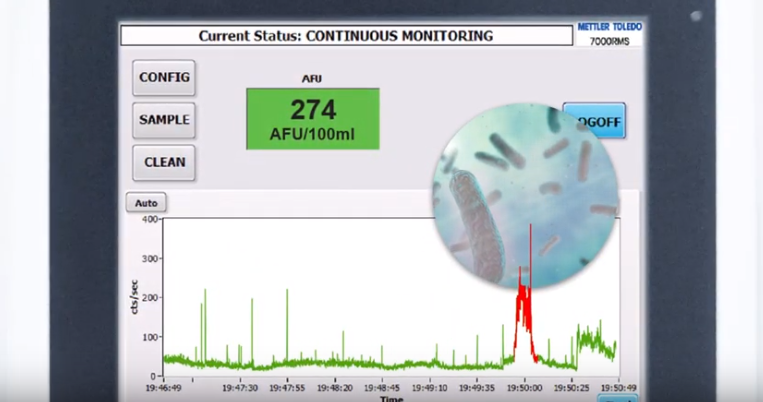
Nell'industria farmaceutica, il monitoraggio microbico dell'acqua purificata, dell'acqua ultrapura e dell'acqua per preparazioni iniettabili non è solo una buona pratica di controllo della qualità; È un requisito normativo. Gli standard stabiliti dalla Farmacopea degli Stati Uniti (USP) stabiliscono le condizioni in cui deve essere testata la contaminazione microbica.
Ad esempio, l'USP <61> delinea i requisiti per i limiti microbici, specificando livelli accettabili di microrganismi nei prodotti non sterili e sottolineando l'importanza della qualità dell'acqua. USP <62> descrive in dettaglio i metodi per rilevare agenti patogeni specifici, tra cui E. coli, Salmonella e Pseudomonas aeruginosa, in acqua sterilizzata. Inoltre, l'USP <1231> sull'acqua per scopi farmaceutici dell'USP ha costantemente approvato il monitoraggio continuo on-line delle acque farmaceutiche. Questo approccio garantisce la raccolta dei dati storici durante il processo, consentendo un controllo efficace dei sistemi idrici e mantenendo la produzione di acqua che soddisfa standard di qualità accettabili.
Il 7000RMS è in linea con USP <1223>, che incoraggia la convalida di metodi alternativi che dimostrano vantaggi in termini di precisione e sensibilità. Aderisce inoltre alle linee guida pubblicate dalla FDA e dall'EMA per i metodi di misurazione microbiologica alternativi, garantendo la conformità agli standard normativi e migliorando il processo di monitoraggio.


.png/_jcr_content/renditions/cq5dam.web.1280.1280.png)