Reaktionsvärmen, eller reaktionsentalpi, är en viktig parameter för att säkert och framgångsrikt skala upp kemiska processer. Reaktionsvärmen är den energi som frigörs eller absorberas när kemikalier omvandlas i en kemisk reaktion. Den beskriver förändringen av energiinnehållet när reaktanter omvandlas till produkter. Medan en reaktion kan vara exoterm (värmefrigörande) eller endoterm (värmeabsorberande), är de flesta reaktioner som utförs inom kemi- och läkemedelsindustrin exoterma. Bland annat är reaktionsvärmen en av de termodynamiska egenskaperna som används i kemisk utveckling, uppskalning och säkerhet för att skala processer från laboratorieskala till tillverkning. Reaktionsvärmen eller reaktionsentalpi uttrycks vanligtvis som molär entalpi i kJ/mol, eller som specifik entalpi i kJ/kg eller kJ/L.
Vad är reaktionens hetta?
Varför behöver jag förstå reaktionens hetta?
Under ganska lång tid har säkerhetsöverväganden blivit en viktig del av kemisk processutveckling, och säkerhetskoncept utvecklas rutinmässigt under utformningen av pilot- eller storskaliga processer. Branschorganisationer och federala myndigheter, såsom CSB, OSHA (USA), HSE (UK), EU-OSHA, EPSC (EU) eller IPE och State Administration of Work Safety (SAWS) i Kina, kräver att kemi- och läkemedelsindustrin följer bestämmelser som garanterar säker produktion. Direktiven fokuserade på att undvika tillbud och olyckor inom kemi- och läkemedelsindustrin.
Riskbedömning kräver viktiga kemiska data som beskriver ämnenas egenskaper, men också information om själva processen. Bland annan termisk information är reaktionsvärmen en viktig parameter som kan användas för att härleda information om säkra processer och för att bygga upp kunskap om processäkerhet. Att bygga upp kunskap om processäkerhet innebär också att förstå både de önskade och möjliga oönskade reaktionerna. Medan den oönskade reaktionen i första hand handlar om att identifiera möjliga sidoreaktioner eller på varandra följande reaktioner som kan följas av en skenande reaktion, visar undersökningen av den önskade reaktionen hur reaktionen beter sig under normala driftsförhållanden.
Ackumuleringen av utgångsmaterial, reaktionsvärmen, reaktionsentalpi och den specifika värmen är några av de nyckelparametrar som krävs för att skapa scenarier för kylfel för den önskade reaktionen. Mer avancerade studier, såsom utvärdering av värsta tänkbara scenarier, kriticitetsklass eller kriticitetsmatrisen, använder dock informationen från reaktionsvärmen i samma utsträckning.
Hur beräknar man reaktionsvärmen eller reaktionsentalpi?

Reaktionsvärmen kan beräknas baserat på standardbildningsvärmen för alla inblandade reaktanter. Det bestäms dock vanligtvis genom att mäta värmeproduktionen över tid med hjälp av en reaktionskalorimeter, såsom en värmeflödeskalorimeter.
Bestämningen av reaktionsvärmen kräver kunskap om den totala värmeflödesbalansen, inklusive värmeflödet genom reaktorväggen, mängden värme som utbyts under dosering av reaktanter eller lösningsmedel och den värme som ackumuleras på grund av en temperaturökning eller minskning.
Medan värmefrigöringshastigheten och reaktionsvärmen ger information om hur värmen frigörs i funktion av tiden, erhålls reaktionsvärmentalpi genom att integrera reaktionsvärmens trend mellan start och slut av reaktionen. Eftersom alla de enskilda värmeflödestermerna är relevanta för den totala värmebalansen, måste man vara noga med att bestämma dem så exakt som möjligt.
Reaktionsvärme av kemiska reaktioner
Är min kemi exoterm?
Mängden reaktionsvärme beror på reaktanterna och de produkter som bildas och är därför en funktion av styrkan hos bindningarna mellan atomerna som är trasiga och nybildade.
Om summan av bildningsvärmen för reaktanterna är större än bildningsvärmen för produkterna är reaktionen exotermisk eller värmefrigörande.
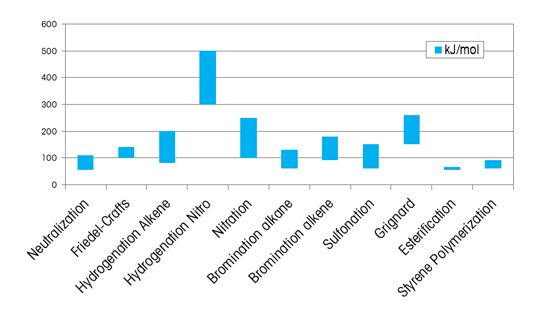
Med andra ord varierar reaktionsvärmen med typen av reaktion och de funktionella grupper som är inblandade. Medan reaktionsvärmen är cirka 50 till 70 kJ/mol för en typisk förestringsreaktion, kan den vara så mycket som 300 till 600 kJ/mol för hydreringsreaktioner av nitroföreningar.
Nedbrytningsreaktioner (t.ex. nedbrytning av sprängämnen) är mycket kraftfullare än någon av de typiska kemiska reaktionerna som tillämpas inom den kemiska och farmaceutiska industrin. Reaktionsvärmen för sådana nedbrytningsreaktioner, även kallad detonationsvärme, är mellan 4 och 7,5 MJ/kg material.
Medan reaktionsvärmen för alla vanliga kemiska reaktioner lätt kan bestämmas i en reaktionskalorimeter, bestäms värmen från nedbrytningsreaktioner antingen med hjälp av matematiska modeller eller med utrustning, såsom differentiella screeningkalorimetrar (DSC), bombkalorimetrar eller så kallade detonationskalorimetrar.
Reaktionsvärme kontra värmeavgivningshastighet
Konsekventa data som stöder säker uppskalning
Reaktionsvärmen beskriver utbytet av den totala mängden energi när reaktanter omvandlas till produkter. Värmeavgivningshastigheten tar dock hänsyn till hur energin frigörs som en funktion av tiden och uttrycks i W eller J/s.
Detta är av grundläggande betydelse, eftersom reaktionens totala entalpi kanske inte är kritisk, men hastigheten med vilken den energin frigörs kan göra skillnaden mellan en säker process och en farlig.
De flesta sats- eller halvsatsreaktorer i tillverkning kan avlägsna mellan 25 och 35 W/L, beroende på storlek och kylningskoncept. Således måste värmeavgivningshastigheten för en kemisk process utformas för att ligga inom ett visst intervall för värmeproduktionshastigheten för att säkerställa att reaktionen kan köras säkert, oberoende av den totala reaktionsvärmen.
Värdet av reaktionsvärmen i processäkerhet
Mängden reaktionsvärme är direkt kopplad till allvarlighetsgraden i händelse av en incident och används särskilt vid bedömning av reaktioner, uppskalning och processäkerhetsrelaterade beräkningar.
Under processäkerhetsutredningar används reaktionsvärme för att beräkna den så kallade adiabatiska temperaturökningen och därefter den maximala temperaturen för syntesreaktionen (MTSR). Den adiabatiska temperaturökningen (ΔTad) är en funktion av mängden ackumulerat utgångsmaterial, reaktionsentalpi, mängden reaktionsmassa och den specifika värmen hos reaktionsmassan. Den beskriver den teoretiska ökningen av reaktionsmassans temperatur, förutsatt att antingen en del av eller hela reaktionen körs adiabatiskt på grund av ett kylningsfel i anläggningen. I ett sådant fall kommer temperaturen på reaktorinnehållet att öka proportionellt mot omvandlingen av det oreagerade materialet. Följaktligen kommer processtemperaturen att öka genom att ΔTad når MTSR.
Teknik för reaktionsvärme
Säkerställ säkerhet genom design
I mer än 30 år har RC1 varit guldstandarden inom reaktionskalorimetri; RC1 är ett instrument du kan lita på. RC1mx bygger vidare på sina föregångare genom att lägga till en nivå av bekvämlighet för snabbare utveckling av bättre optimerade, mer robusta och ekonomiskt lönsamma processer.
- Förstå din process
Bestäm termodynamiska data snabbt och exakt under isotermiska eller icke-isotermiska förhållanden. - Värmeflödeskalorimetri – helt enkelt pålitlig
Värmeflödeskalorimetri är immun och robust mot yttre påverkan och gör det möjligt att noggrant och exakt mäta värmeutvecklingen under processförhållanden. - Mät den verkliga reaktionsvärmen
Att mäta den verkliga reaktionsvärmen är grunden för att förstå utvecklingen av kemiska reaktioner, deras kinetik och dess riskpotential.
Termisk omvandling vs kemisk omvandling av en reaktion

Den termiska omvandlingen är relevant information för kemisk processutveckling, och beskriver sambandet mellan den partiella reaktionsvärmen som en funktion av tiden och den totala reaktionsvärmen. Beräkningen av den termiska omvandlingen baseras enbart på den värme som frigörs under reaktionen i motsats till den kemiska omvandlingen, som baseras på den kemiska omvandlingen från reaktanter till produkter.
Medan den termiska omvandlingen i slutet av reaktionen alltid är 100 %, kan den kemiska omvandlingen vara lägre och varierar beroende på valet av processparametrar. Det är verkligen målet för kemisk utveckling att uppnå högsta möjliga omvandling av reaktanter, vilket resulterar i högsta möjliga utbyte.
Reaktionskalorimetri i kombination med realtidsanalys, såsom in-situ FTIR-spektroskopi, är en idealisk metod för att studera utvecklingen av en kemisk reaktion, omvandlingen av reaktanter, bildningen av produkter, biprodukter och intermediärer, samtidigt som termodynamisk information, såsom reaktionsvärmen, värmeflödet, den specifika värmen eller värmeöverföringen samtidigt.
Studie av reaktionskalorimetri leder till kapital- och kostnadsbesparingar

Tack vare information som erhållits från RC1 (t.ex. reaktionsvärme, värmekapacitet och värmeproduktionshastighet) kunde en etablerad men utmanande process optimeras och implementeras i stor skala på mycket kort tid. Optimeringen resulterade i besparingar på cirka 70 000 USD eftersom inget pilotsteg krävdes. Dessutom kan årliga besparingar på 50 000 USD på produktionskostnader realiseras på grund av den billigare utrustningen och den större batchstorleken.
Båda stegen i en indolsyntes, fenylhydrazonsyntesen följt av en Fischer-ringförslutning, undersöktes i en RC1-reaktionskalorimeter.
Huvudfokus för undersökningen låg på värmeavgivningshastigheten, reaktionsvärmen och värmeöverföringen, samt inverkan av reaktionstemperaturen, och i ett senare skede, doseringshastigheten på informationen ovan. Baserat på experimentella data, temperatur och doseringsregim, samt tid och kylning, kunde prestanda som krävs för driften i anläggningens reaktor uppskattas. Det faktum att den befintliga processen kunde modifieras för att bli praktiskt taget dosstyrd förbättrade också säkerheten i tillverkningsskala, vilket avsevärt eliminerade behovet av dyra säkerhetsåtgärder.

Accelerera processutvecklingen med Dynochem
Säkerställ effektiv blandning och värmeöverföring vid uppskalning
Använd Dynochem-modellering för att säkerställa effektiv blandning och värmeöverföring vid uppskalning av reaktioner. Dynochem gör det enkelt att snabbt jämföra reaktorer i labb-, pilot- och produktionsskala och hitta lämpliga blandningsparametrar för att på ett säkert sätt påskynda processöverföringen från reaktor till reaktor. Med data från reaktionskalorimetri och Dynochem-modellering kan du snabbt säkerställa kemisk processäkerhet och processprestanda i alla skalor.
Trycksaker
Reaktionsvärme i branschrelaterade publikationer
Nedan följer ett urval av publikationer som behandlar reaktionsvärmen eller reaktionsentalpi.
- Agosti, A., Bertolini, G., Bruno, G., Lautz, C., Glarner, T., & Deichtmann, W. (2017). Hantering av väteperoxidoxidationer i stor skala: Syntes av 5-brom-2-nitropyridin. Organisk processforskning och utveckling, 21(3), 451–459. https://doi.org/10.1021/acs.oprd.6b00433
- Changi, S. M., & Wong, S. W. (2016). Kinetikmodell för att designa Grignardreaktioner i batch- eller flödesoperationer. Organisk processforskning och utveckling, 20(2), 525–539. https://doi.org/10.1021/acs.oprd.5b00281
- Glotz, G., Knoechel, D. J., Podmore, P., Gruber-Woelfler, H., & Kappe, C. O. (2017). Reaktionskalorimetri i mikroreaktormiljöer—Mätning av reaktionsvärme med isoterm värmeflödeskalorimetri. Organisk processforskning och utveckling, 21(5), 763–770. https://doi.org/10.1021/acs.oprd.7b00092
- Lakshminarasimhan, T. (2014). Förutsäga 24 och 8 timmars adiabatisk nedbrytningstemperatur för lågtemperaturreaktioner genom kinetisk anpassning av icke-isoterma värmedata från reaktionskalorimeter (RC1e). Organisk processforskning och utveckling, 18(2), 315–320. https://doi.org/10.1021/op400301f
- Mitchell, C. W., Strawser, J. D., Gottlieb, A., Millonig, M. H., Hicks, F. A., & Papageorgiou, C. D. (2014). Utveckling av en modelleringsbaserad strategi för säker och effektiv uppskalning av högenergetiska hydrogenationsreaktioner. Organisk processforskning och utveckling, 18(12), 1828–1835. https://doi.org/10.1021/op500207r
- Wang, J., Huang, Y., Wilhite, B. A., Papadaki, M., & Mannan, MS (2018). Mot identifiering av intensifierade reaktionsförhållanden med hjälp av responsytmetodik: En fallstudie om syntes av 3-metylpyridin N-oxid. Forskning inom industriell och teknisk kemi, 58(15), 6093–6104. https://doi.org/10.1021/acs.iecr.8b03773







