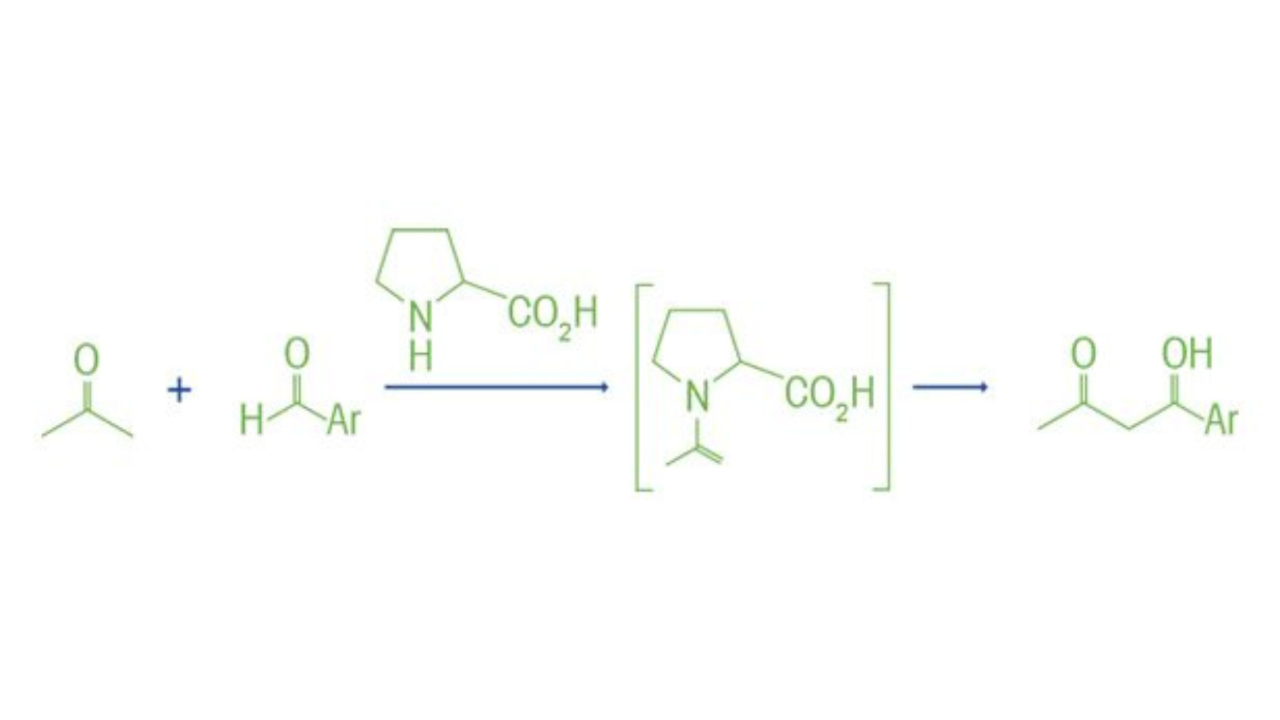
Zhang, Z., Bae, H. Y., Guin, J., Rabalakos, C., Van Gemmeren, M., Leutzsch, M., Klussmann, M., & List, B. (2016). Asymmetrisk kontraanjonriktad Lewis-syraorganokatalys för skalbar cyanosilering av aldehyder. Nature Communications, 7(1). https://doi.org/10.1038/ncomms12478
Författarna rapporterar att de utvecklat en asymmetrisk Lewis-syraorganokatalysmetod för cyanosilering av aldehyder med hjälp av trimetylsilylcyanid och en kiral disulfonimidförkatalysator. Som ett resultat av den höga aktiviteten var katalysatorbelastningar på 0,05 % till 0,005 % effektiva för att producera den önskade cyanohydrinprodukten. Författarna rapporterar att en inaktiv period av katalysatorn observeras som kan induceras reversibelt av vatten. In-situ FTIR användes för att ytterligare förstå denna utveckling och gav betydande insikt i den pre-katalytiska cykeln.
För att övervaka koncentrationen av aldehydreaktanten spårades det 1703 cm-1 karbonylbandet jämfört med tiden. Intressant nog observerades ingen reaktion under en period, varefter omvandlingen fortsatte ganska snabbt. Författarna trodde att orsaken till viloperioden kunde vara relaterad till vatten i reaktionsblandningen, och ett experimentellt protokoll för att tillsätta kontrollerade mängder vatten till reaktionsblandningen bevisade att vatten verkligen var ansvarigt för bristen på aktivitet via hydrolys av den katalytiskt aktiva arten. I tidigare arbete där en silylketenacetal reagerade med en aldehyd i närvaro av en disulfonimidkatalysator observerades ingen vilande period. De trodde att detta kunde bero på den höga reaktiviteten hos silylketenacetalen med förkatalysatorn, som omedelbart regenererar den aktiva Lewis-syraorganokatalysatorn. För att testa denna hypotes i det aktuella arbetet använde de en katalytisk mängd silylketenacetal som aktivator och fann att den vilande perioden undveks. Baserat på ytterligare experiment föreslog de en pre-katalytisk cykel som återspeglar den vilande perioden.